DIE ZUKUNFT DER
KOMPLEXEN BIOLOGIE
Das automatisierte CellXpress.ai Zellkultursystem
Sehen Sie den Unterschied. Wählen Sie das Beste aus. QPix FLEX Mikrobenkolonie-Picksystem
Tauchen Sie tiefer ein: ImageXpress HCS.ai High-Content-Screening-System mit KI-gestützten Erkenntnissen
Branchenführende SpectraMax® Mikroplatten-Reader und SoftMax® Pro Software
Fortschritte bei der wissenschaftlichen Entdeckung
Es ist uns ein Anliegen, Forscher mit Technologien der nächsten Generation auszustatten und sie zu innovativen Lösungen zu inspirieren, die die wissenschaftliche Forschung vorantreiben, um die Lebensqualität der Menschen weltweit zu verbessern.
Ein Life-Science-Unternehmen
Seit vier Jahrzehnten machen wir es zu unserer Aufgabe, Life-Science-Labore der Zukunft zu ermöglichen, in denen innovative Technologie und neuartige Forschung verschmelzen.


Hochmoderne automatisierte 3D-Imaging-Arbeitszelle
Das Organoid Innovation Center von Molecular Devices vereint modernste Technologien mit neuartigen Forschungsmethoden, um die wichtigsten Herausforderungen der Maßstabsvergrößerung komplexer biologischer 3D-Modelle zu lösen.
Der Teamarbeitsbereich bringt Kunden und Forscher gemeinsam ins Labor, um automatisierte Arbeitsabläufe für die Kultivierung und das Screening von Organoid-Kulturen zu testen – unter Anleitung unserer betriebsinternen Wissenschaftler.
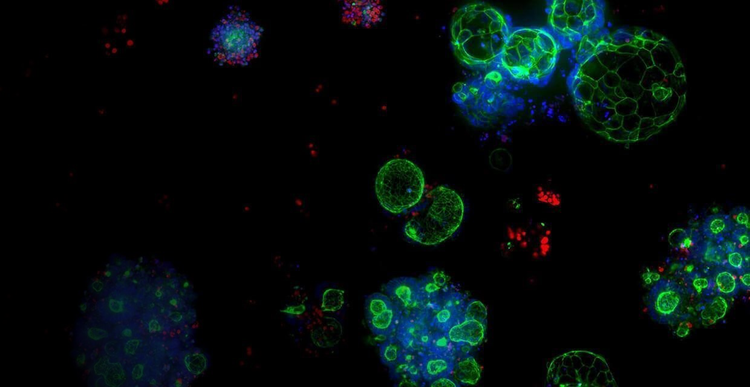
3D-Biologie
Die Pionierarbeit für eine neue Zukunft der Wirkstoffforschung auf der Grundlage der 3D-Biologie wird Forschern die Möglichkeit geben, Therapien zu personalisieren, die Zeit bis zur Markteinführung eines Medikaments zu verkürzen und die Lebensqualität von Patienten in aller Welt zu verbessern.
Durch den Einsatz unserer firmeneigenen Bioprozesstechnologie stellen wir zuverlässige und vorhersagbarer Organoide in großem Umfang her, um das Zellkultursystem der Zukunft zu entwickeln. Deshalb glauben wir an das revolutionäre Potenzial der 3D-Biologie.

Zelltechnologie
Mit unserer Colony Picker Plattform erweitern wir die hochmodernen Methoden und Technologien des Zentrums, um automatisierte Arbeitsabläufe für die synthetische Biologie, das Antikörper-Discovery und die Zelllinienentwicklung zu integrieren.
Zusätzlich steht mit der kürzlichen Markteinführung des CloneSelect® Imager FL mit Mehrkanal-Fluoreszenz zur Überprüfung der Monoklonalität am Tag Null und zur Bestätigung von CRISPR-Edits jetzt eine breite Palette an Zell- und Gentherapie-Anwendungen zur Verfügung.
Labor-Automatisierung und kundenspezifische Anpassung

Von unseren promovierten Mitarbeitern des technischen Kundendiensts bis hin zu unseren geschulten und zertifizierten Außendiensttechnikern führen wir Wissenschaftler wie Sie durch maßgeschneiderte Automatisierungslösungen, die auf die speziellen Anforderungen Ihres Assays, Ihrer Methode oder Ihres Protokolls zugeschnitten sind.
Entdecken Sie unsere integrierten Komplettlösungen für das Hochdurchsatz-Screening:
Automatisiertes High-Content-Screening
Wir verleihen Wissenschaftlern die Fähigkeit, die Forschung voranzutreiben
Unsere automatisierten Komplettlösungen überspannen Forschungsdisziplinen, um Wissenschaftler bei der Entdeckung, Skalierung und Industrialisierung der Biologie zu unterstützen.

Benutzerfreundliche, intuitive, konfigurierbare Mikroplatten-Reader
Seit über 40 Jahren arbeiten wir mit Wissenschaftlern zusammen, um die Grenzen ihrer Forschung zu erweitern. Unsere SpectraMax Mikroplatten-Reader und unsere SoftMax Pro Software sind die in der Branche am meisten zitierten, und sie haben Life Science-Forscher dazu befähigt, die Protein- und Zellbiologie voranzubringen – und dadurch den Weg für neuartige und bahnbrechende Entdeckungen freizumachen.

Optimieren Sie Ihren Weg zur GxP-Compliance für GMP/GLP-Labore
Als führender Anbieter umfassender GxP-Compliance-Lösungen kombinieren wir unsere SpectraMax® Microplate Reader mit der SoftMax® Pro GxP Software, SpectraTest® Validation Plates und fachkundigen IQ/OQ/PM-Dienstleistungen, so dass Laboratorien, die unter GMP- und GLP-Bestimmungen arbeiten, bei der sicheren Einhaltung der FDA-Richtlinien oder regionalen Richtlinien unterstützt werden.
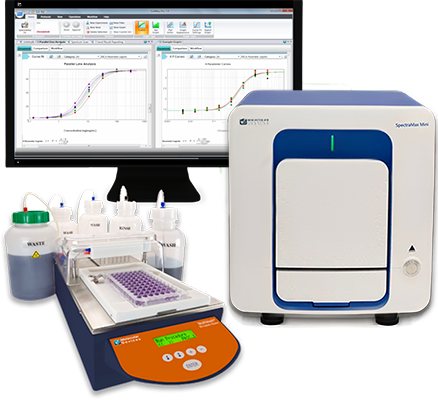
Sparen Sie mit dem Paket: Mikroplatten-Reader und -Wascher
Verbessern Sie die Effizienz Ihres Labors, gewinnen Sie mehr Daten und verkürzen Sie die Zeit bis zu Entdeckungen – mit einer automatisierten Lösung aus Mikroplatten-Reader und -Wascher:
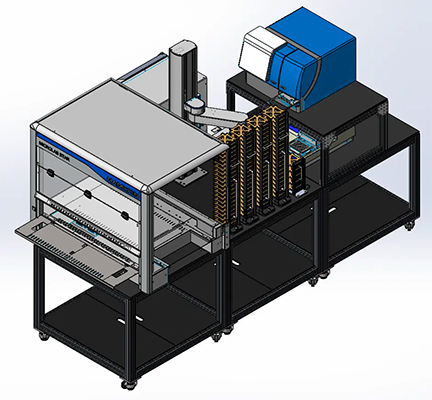
Laborautomatisierung für plattenbasierte Hochdurchsatz-Assays
Erkunden Sie unsere vollständig integrierten Lösungen automatisierter Arbeitsabläufe für zelluläre und biochemische Assays. Unsere skalierbaren ELISA-Arbeitszellen sorgen dafür, Zeit für andere Arbeiten frei zu machen, den Durchsatz, die Effektivität und die Effizienz der Assay-Verfahren zu steigern und die Reproduzierbarkeit zu erhöhen.

Benutzerfreundliche, intuitive, konfigurierbare Mikroplatten-Reader
Seit über 40 Jahren arbeiten wir mit Wissenschaftlern zusammen, um die Grenzen ihrer Forschung zu erweitern. Unsere SpectraMax Mikroplatten-Reader und unsere SoftMax Pro Software sind die in der Branche am meisten zitierten, und sie haben Life Science-Forscher dazu befähigt, die Protein- und Zellbiologie voranzubringen – und dadurch den Weg für neuartige und bahnbrechende Entdeckungen freizumachen.

Optimieren Sie Ihren Weg zur GxP-Compliance für GMP/GLP-Labore
Als führender Anbieter umfassender GxP-Compliance-Lösungen kombinieren wir unsere SpectraMax® Microplate Reader mit der SoftMax® Pro GxP Software, SpectraTest® Validation Plates und fachkundigen IQ/OQ/PM-Dienstleistungen, so dass Laboratorien, die unter GMP- und GLP-Bestimmungen arbeiten, bei der sicheren Einhaltung der FDA-Richtlinien oder regionalen Richtlinien unterstützt werden.

Laborautomatisierung für plattenbasierte Hochdurchsatz-Assays
Erkunden Sie unsere vollständig integrierten Lösungen automatisierter Arbeitsabläufe für zelluläre und biochemische Assays. Unsere skalierbaren ELISA-Arbeitszellen sorgen dafür, Zeit für andere Arbeiten frei zu machen, den Durchsatz, die Effektivität und die Effizienz der Assay-Verfahren zu steigern und die Reproduzierbarkeit zu erhöhen.


ImageXpress® HCS.ai High-Content-Screening-System für überlegene Datenanalysen und KI-gesteuerte Einblicke
Das System zeichnet sich durch sein fortschrittliches, modulares Design aus, sowie die Fähigkeit, schnell kristallklare Bilder komplexer Zellmodelle aufzunehmen, mit intuitiver Software detaillierte Daten zu erfassen und durch KI-gesteuerte Analysen tiefe Einblicke zu gewähren.


Einführung des revolutionären automatisierten Zellkultursystems CellXpress.ai™
Das CellXpress.ai-System, ein KI-gesteuertes Innovationszentrum für Zellkulturen, automatisiert Prozesse, verbessert Arbeitsabläufe und macht Assays durch von maschinellem Lernen unterstützte Überwachung, Fütterung, Imaging und Planung zuverlässiger und reproduzierbarer.
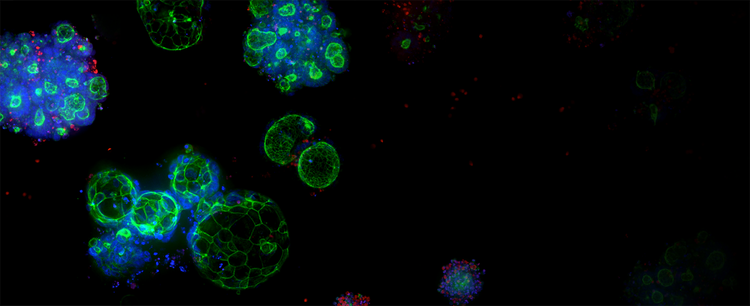
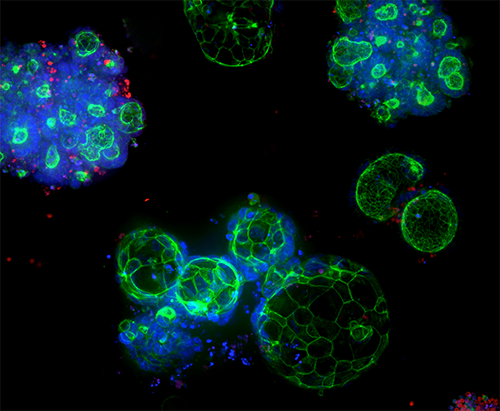
3D Ready Organoide und Organoid-Expansionsservice
Die qualitätskontrollierten Organoide werden in großem Maßstab für hohen Screening-Durchsatz hergestellt, wobei firmeneigene Bioreaktor- und Bioprozesstechnologie zur Herstellung zuverlässiger und vorhersagbarer von Patienten stammenden Organoiden (PDOs) genutzt wird.

Das QPix® FLEX™ Mikrobenkolonie-Picksystem für Präzision, Flexibilität und platzbegrenzte Umgebungen
Plattieren, Ausstreichen, Picken und Liquid Handling – alles in einem kompakten Gerät? Der QPix FLEX Mikrobenkolonie-Picker macht es einfach. Mit fortschrittlichem Farb-Imaging können Sie die richtigen Kolonien schneller erkennen. Und ja, er passt auf Ihren Labortisch oder in eine Hypoxiekammer – warum auch nicht? Das QPix FLEX-System ersetzt das Durcheinander durch ein intelligentes, optimiertes System, das Ihre Forschung voranbringt.

Screening-Systeme für Klone zum Picken von Kolonien und zur Isolierung einzelner Zellen
Der QPix® 400 Microbial Colony Picker, der ClonePix® 2 Mammalian Colony Picker und der CloneSelect® FL Imager erhöhen den Durchsatz und die Konsistenz in allen Arbeitsabläufen der Zelllinienentwicklung, der Entdeckung monoklonaler Antikörper und der synthetischen Biologie.

Automatisierte Lösungen für das High-Throughput-Klon-Screening
Vollständig integrierte Labor-Automatisierungs-Lösungen für molekulares Klonieren, Antikörper-Discovery und Monoklonalitätsbestimmung. Unsere automatisierten Arbeitsabläufe des Klon-Screenings integrieren Laborinstrumente, die Ihren Durchsatz steigern und Ihre Effizienz erhöhen, während sie gleichzeitig die Notwendigkeit des Eingreifens von Personen verringern.

Einzelzell-Dispension und Screening zur Überprüfung der Monoklonalität.
Der preisgekrönte DispenCell™ Einzelzelldispenser und der CloneSelect® Imager FL – unsere gebündelte Lösung bietet unvergleichliche Präzision und Effizienz bei der Entwicklung von Zelllinien und Überprüfung der Monoklonalität am Tag Null.

Screening-Systeme für Klone zum Picken von Kolonien und zur Isolierung einzelner Zellen
Der QPix® 400 Microbial Colony Picker, der ClonePix® 2 Mammalian Colony Picker und der CloneSelect® FL Imager erhöhen den Durchsatz und die Konsistenz in allen Arbeitsabläufen der Zelllinienentwicklung, der Entdeckung monoklonaler Antikörper und der synthetischen Biologie.

Automatisierte Lösungen für das High-Throughput-Klon-Screening
Vollständig integrierte Labor-Automatisierungs-Lösungen für molekulares Klonieren, Antikörper-Discovery und Monoklonalitätsbestimmung. Unsere automatisierten Arbeitsabläufe des Klon-Screenings integrieren Laborinstrumente, die Ihren Durchsatz steigern und Ihre Effizienz erhöhen, während sie gleichzeitig die Notwendigkeit des Eingreifens von Personen verringern.
Wir sind Wissenschaftler, die Wissenschaftler unterstützen
Wir verleihen Wissenschaftlern die Fähigkeit, ihre Entdeckungen voranzutreiben, um Patienten frühere Diagnosen und sicherere Therapeutika zu bieten.

3D-Biologie: Der Paradigmenwechsel in der nächsten Generation der Wirkstoffforschung
Inmitten eines sich wandelnden Paradigmas in der Wirkstoffforschung gehen Forscher weltweit dazu über, ihre Verbindungen nicht mehr in 2D-Zellkulturen und Tiermodellen, sondern in komplexeren, für den Menschen relevanten 3D-Systemen wie Organoiden zu screenen. In unserer interaktiven Infografik erfahren Sie, warum die Branche diese nächste Generation der Wirkstoffforschung begrüßt und welche Innovationen die Forscher auf ihrem Weg zur 3D-Biologie unterstützen.
Wirkstoffforschung und Wirkstoffentwicklung
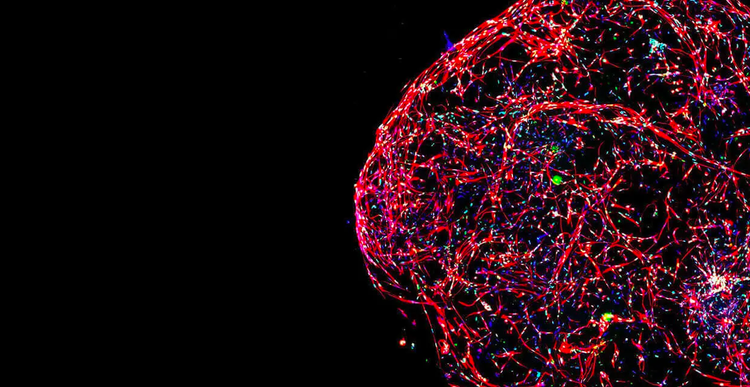
Die Landschaft der Wirkstoffforschung verändert sich: immer mehr Wissenschaftler konzentrieren sich bei der Entwicklung von Zelllinien, Krankheitsmodellen und Hochdurchsatz-Screening-Methoden auf physiologisch relevante 3D-Zellmodelle.
Der Grund hierfür ist klar: die Verwendung von Zellmodellsystemen in der Forschung, die den Krankheitszustand von Patienten oder menschlichen Organen genau nachahmen, kann lebensrettende Therapeutika schneller auf den Markt bringen.
3D-Zellmodelle
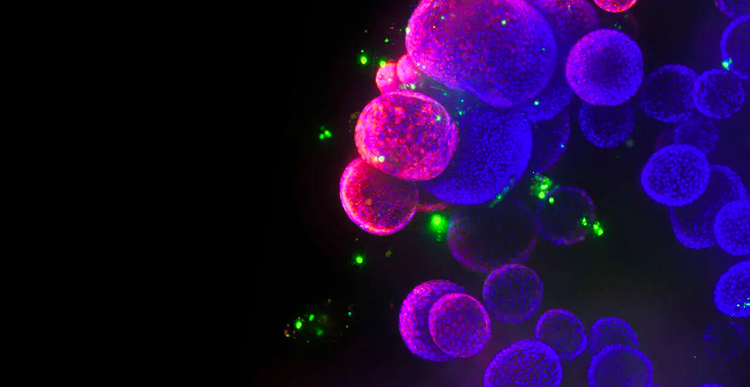
Mit unseren automatisierten 3D-Zellkultur- und Bioimaging-Screening-Lösungen tragen wir dazu bei, die Zukunft der Wirkstoffforschung neu zu gestalten. Mit Hilfe unserer Technologie und unserer Organoid-Entwicklungsprotokolle können Forscher nun Screening-Methoden für physiologisch relevante 3D-Modelle weiterentwickeln und skalieren, die die Krankheitszustände von Patienten und menschlichen Organen wirklichkeitsgetreuer nachahmen, was zu einer schnelleren Entwicklung und Zulassung von Wirkstoffen führt.
Zelllinienentwicklung
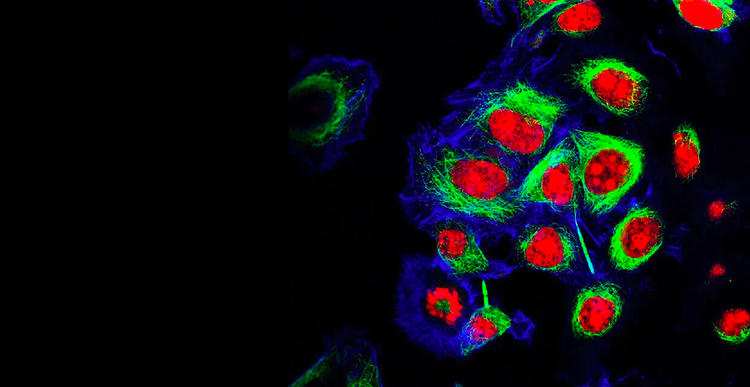
Unsere Kunden, die Zelllinien entwickeln, beschleunigen die Markteinführung von lebensrettenden monoklonalen Antikörpern (mAbs) und die Anwendung genomischer Medizin. Auch betreiben sie bahnbrechende Forschung in den Bereichen Zell- und Gentherapien, Gentechnik, personalisierte und Präzisionsmedizin, synthetische Biologie, RNA- und DNA-basierte Impfstoffe und vielen anderen Bereichen – was ihnen durch unsere innovative Technologie und unser umfassendes Know-how ermöglicht wird.
Wirkstoffscreening
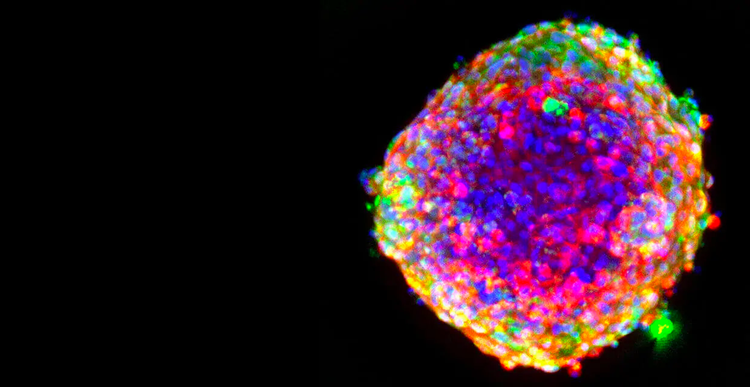
Auf jedes Medikament, das es bis zur Ziellinie schafft, kommen neun weitere, die es nicht schaffen. Diese dramatische Misserfolgsrate lässt sich darauf zurückführen, dass man sich auf 2D-Zellkulturen verlässt, die die komplexe menschliche Biologie nicht annähernd nachahmen – was häufig zu ungenauen Vorhersagen über das Potenzial eines Wirkstoffs und zu verlängerten Entwicklungszeiten führt.
Das Wirkstoffscreening, ein entscheidender Schritt in der Wirkstoffforschung, sowie die Toxizitätsbestimmung bringen die Wirkungen potenziell lebensrettender Verbindungen ans Licht. Die Umstellung auf zellbasierte Tests ermöglicht eine schnelle Prüfung mehrerer Chemikalien gleichzeitig und gibt die menschliche Biologie besser wieder.





