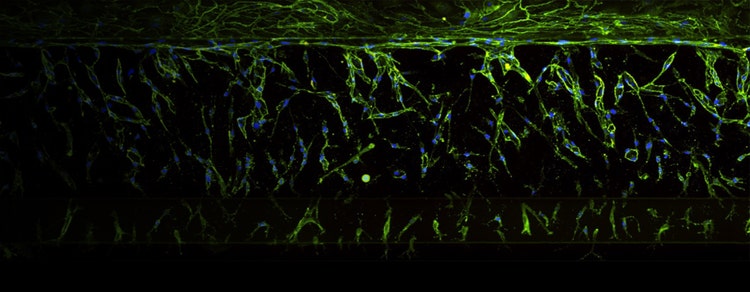
Organ-on-a-Chip
Screenen Sie automatisierte Organ-on-a-Chip-Zellmodelle im High-Throughput-Format mittels High-Content-Imaging und 3D-Analyse
Was ist Organ-on-a-Chip?
Organ-on-a-Chip (OoC) ist eine Technologie, die Mikrofertigungstechniken nutzt, um Miniaturmodelle biologischer Organe, wie Lunge, Herz oder Darm auf einem Chip-großen Träger zu erzeugen. Diese mittels Mikrofertigung hergestellten Träger sind mit lebenden Zellen bestückt, die auf einer Mikroplattform herangezüchtet wurden und die Struktur und Funktion des Organs nachahmen, das sie repräsentieren. Die Zellen sind in der Regel so angeordnet, dass sie die native dreidimensionale Struktur des Organs nachahmen und mit Flüssigkeiten wie Blut oder mit Luft perfundiert werden, um die physiologische Umgebung des Organs wiederzugeben.
Die OoC-Technologie wird verwendet, um genauere und zuverlässigere Modelle von Organen und Geweben zu erzeugen, die die komplexe Mikroumgebung und die Interaktionen von Zellen innerhalb eines Organs besser wiedergeben können. 3D-Zellmodelle können verwendet werden, um bei Krankheitsstudien, in der Wirkstoffentwicklung und der Toxikologie genauere und realistischere Untersuchungen auszuführen als mit herkömmlichen 2D-Zellkulturen.
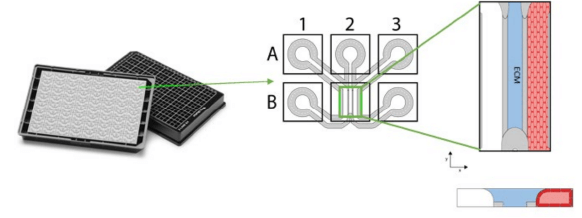
Der OrganoPlate® Chip mit 3 Spuren und 64 Kulturen sowie schematische Darstellung zusammen mit der Illustration eines Tubulus aus Zellen, die auf einem ECM-Gel gezüchtet wurden.
Wie funktioniert die Organ-on-a-Chip-Technologie?
Die Organ-on-a-Chip-Technologie besteht in der Regel aus einem Polymermaterial, das in eine Form gegossen wird, die bestimmte Aspekte der Morphologie des gewünschten Organs nachahmt. Die Zellen werden dann auf dem Chip ausgesät und können wachsen und funktionelle 3D-Strukturen ausbilden, die der Zellzusammensetzung und Struktur von Geweben ähneln. In einigen Fällen kann der Chip so ausgelegt sein, dass er mikrofluidische Kanäle enthält, die das Mikrogefäßsystem eines Organs nachahmen, um den Zellen fließendes Blut zur Verfügung zu stellen oder andere physiologische Bedingungen wie z. B. Nährstoffe und Sauerstoff.
Um eine realistischere Wiedergabe des zu untersuchenden Organs zu erhalten, können verschiedene Zelltypen zur Bildung einer 3D-Struktur kombiniert werden. Dies kann durch das Einsetzen verschiedener Zellschichten oder durch die Verwendung von Hydrogel-basierten Matrizen erfolgen, die die extrazelluläre Matrix des Organs nachahmen. Es können verschiedene Techniken angewendet werden, um die mechanische, elektrische und chemische Mikroumgebung des Organs nachzuahmen. Zum Beispiel kann der Chip mit Flüssigkeiten perfundiert werden, um fließendes Blut bereitzustellen, oder er kann mechanisch stimuliert werden, um Herzkontraktionen zu imitieren. Darüber hinaus können Sensoren in den Chip integriert werden, um Parameter wie Sauerstoffkonzentration, pH-Wert und Temperatur zu messen und so die Gesundheit und Funktion der Zellen zu überwachen.
Der Chip wird in einen Inkubator gestellt, in dem das Zellwachstum mithilfe verschiedener Techniken wie Mikroskopie, Imaging oder biochemischer Assays überwacht werden kann. Sobald der Chip voll funktionsfähig ist, können Wissenschaftler ihn nutzen, um Krankheitsforschung und Studien zur Wirkstoffentwicklung und Toxikologie kontrolliert und hochgradig reproduzierbar auszuführen. Denn mit diesem Chip können bei jedem Experiment dieselben Bedingungen auf dieselbe Weise nachgeahmt werden – so dass Wissenschaftler die Daten aus vielen verschiedenen Experimenten mit verschiedenen Behandlungen konsistent vergleichen können.
Automatisierung des Organ-on-a-Chip-Assays für das High-Throughput-Screening
Hier beschreiben wir einen Arbeitsablauf zur Automatisierung der OoC-Kultur sowie zur Überwachung und automatisierten Zellanalyse. Diese automatisierte Methode nutzt eine integrierte Arbeitszelle, die mehrere Instrumente umfasst und die Automatisierung und Überwachung der Zellkultur ermöglicht. Das High-Content-Imaging-System ermöglicht die Charakterisierung der Entwicklung der 3D-Zellmodelle sowie Tests zu den Wirkungen von Verbindungen. Das integrierte System umfasst das ImageXpress® Micro Confocal High-Content Imaging System, einen automatischen CO2-Inkubator, einen Liquid Handler (Biomek i7) und einen übergreifend arbeitenden Roboter. Wir haben Methoden zur Automatisierung der Zellaussaat, des Medienaustauschs und zur Überwachung der Entwicklung und des Wachstums von 3D-Blutgefäßen entwickelt. Darüber hinaus ermöglicht die Methode automatisierte Tests von Verbindungen und die Beurteilung von Toxizitätseffekten.
Sehen Sie sich die Posterpräsentation von Oksana Sirenko, Senior Application Scientist bei Molecular Devices, an. Sie zeigt, wie unsere High-Content-Imaging-Lösungen das Scale-up sowie die Automatisierung des 3D-Imaging von Organ-on-a-Chip-Systemen ermöglichen.
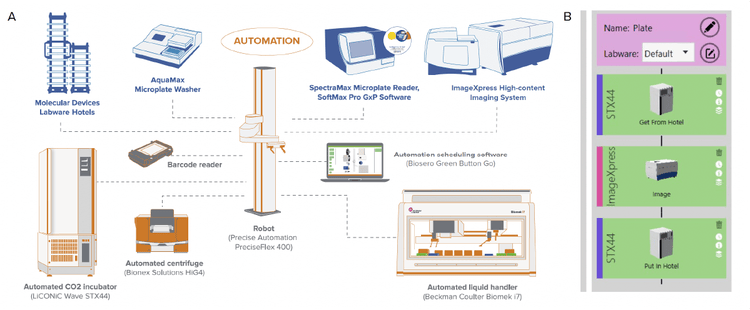
Abbildung 1. Die Anordnung der einzelnen Instrumente in der Arbeitszelle ist in (A) dargestellt. Die Instrumente werden von einer integrierten Software (Green Button Go) gesteuert, die das Einrichten von Prozessen ermöglicht. Ein Beispiel des Prozesses zur Überwachung von Zellen in Kultur ist in (B) dargestellt. Hier werden die Platten für das Hellfeld-Imaging vom Inkubator zum ImageXpress Confocal HT.ai und dann zurück zum Inkubator bewegt. Der Prozess kann auch geplant werden und die abzulichtenden Platten können als Liste eingegeben werden, um eine einfachere Chargenverarbeitung zu ermöglichen. Auch können komplexere Routinen umgesetzt werden, die den Liquid Handler für den Medienaustausch (Füttern) mit einbeziehen.
Organ-on-a-Chip – Anwendungen und Assays
Die Kombination dieser komplexen Biologie mit fortschrittlichen High-Content-Imaging-Techniken und den 3D-Analysefähigkeiten von KI/maschinellem Lernen ermöglicht Assays auf einer völlig neuen Ebene. Hier teilen wir unsere Methoden zur Automatisierung der Zellkultur, der Assays und der Analyse, die die Werkzeuge liefern können, um die Nutzung von Organ-on-a-Chip-Systemen zu erleichtern und zu erweitern.