
Tipps für die Durchführung eines erfolgreichen Imaging-Experiments mit lebenden Zellen
Im Verlauf der letzten Jahrzehnte wurden signifikante Fortschritte in der Mikroskopie- und Kameratechnologie gemacht, ebenso wie Fortschritte in den Technologien zur Markierung von zu untersuchenden Molekülen. Diese Fortschritte haben zu einer erhöhten Prävalenz des Lebendzell-Imaging in einer Vielzahl von Bereichen geführt, von der Grundlagenforschung bis hin zu fortgeschrittenen Studien in der Neurobiologie, Entwicklungsbiologie, Krebsforschungund Wirkstoffentwicklung. Über diese Felder hinweg kann das Lebendzell-Imaging verwendet werden, um zelluläre Prozesse zu untersuchen, die über einen Zeitraum von der Gesamtorganismenebene bis hinunter zur Molekularebene stattfinden.
Obwohl es viele Anwendungen für das Lebendzell-Imaging und viele verschiedene Mikroskopiemethoden gibt, die verwendet werden können, besteht eine häufige Herausforderung darin, die Probenintegrität während des Versuchs aufrechtzuerhalten, während Bilder mit ausreichender Auflösung aufgenommen werden. Diese beiden Faktoren sind entscheidend, um relevante und reproduzierbare Daten aus Ihren Lebendzell-Imaging-Experimenten zu erhalten.
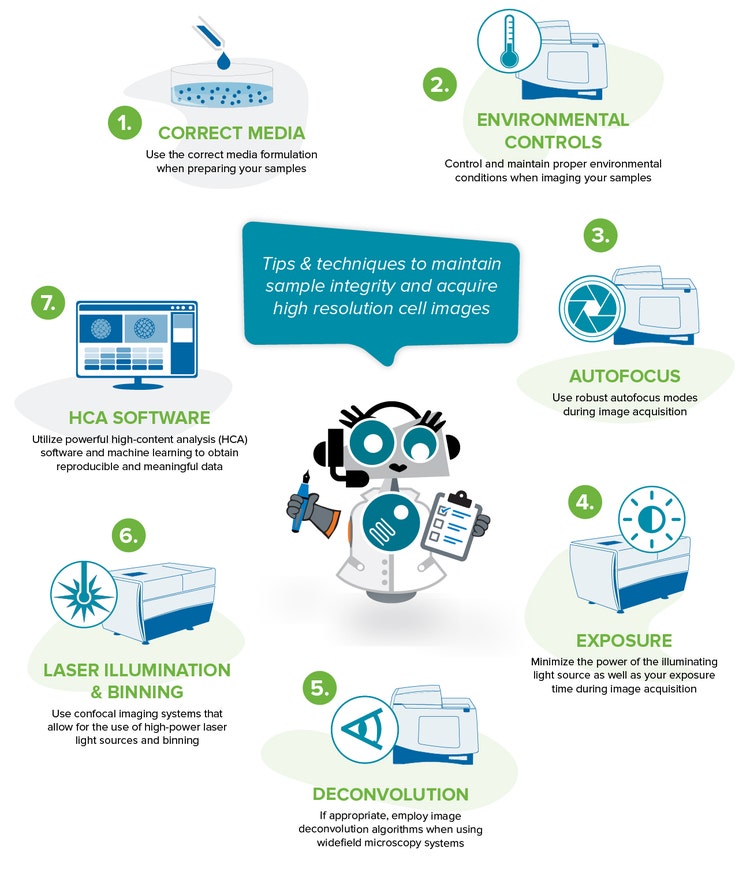
Laden Sie die Infografik herunter
Best Practices zur Gewinnung relevanter und reproduzierbarer Daten
Hier sind einige Tipps und Techniken, die Ihnen helfen, die Gesundheit Ihrer Probe zu erhalten und ein erfolgreiches Lebendzell-Imaging-Experiment durchzuführen.
1. Verwenden Sie bei der Vorbereitung Ihrer Proben die richtige Medienformulierung
Neben der Sicherstellung, dass Medienformulierungen die geeigneten Nährstoffe enthalten, um das Wachstum und die Entwicklung von Zellen zu fördern, sind Faktoren wie pH, Pufferkapazität und Osmolarität für die Durchführung eines erfolgreichen Lebendzell-Imaging-Experiments von entscheidender Bedeutung. Veränderungen des pH-Werts und der Osmolarität des Mediums (d. h. die Menge des gelösten Stoffes in der Medienlösung) können die Expression von Zellen und deren Phänotyp beeinflussen und letztendlich beeinflussen, wie sie aussehen und sich verhalten. Die Regulierung und Aufrechterhaltung optimaler Umgebungsbedingungen trägt dazu bei, unerwünschte oder schädliche Veränderungen der Medien zu verhindern.
Darüber hinaus gibt es viele Faktoren in den Medien, die zur Autofluoreszenz unseres hohen Hintergrundsignals in Ihren Bildern beitragen können. Erwägen Sie die Verwendung von phenolrotfreien Medien und reduzieren Sie die Serumkonzentration. Dadurch wird das Hintergrundsignal erheblich reduziert.
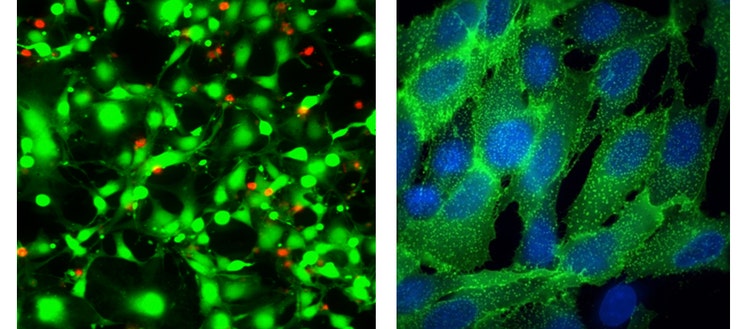
Links: 40X Plan Apo-Bild von HeLa-Zellen, die 18 Stunden lang mit Straurosporin behandelt und dann mit dem EarlyTox™ Live Dead Assay gefärbt wurden – calcein AM (grün) und Ethidiumhomodimer-III (rot)
Rechts: 100X Plan Apo (Luft)-Bilder von Transfluor U2OS, behandelt mit Isoproterenol, um die Rezeptor-Internalisierung zu stimulieren, die durch GFP-markiertes ß-Arrestin (grün) visualisiert wird. Die Zellen wurden mit der Hoechst33342-Kernfärbung gegengefärbt.
2. Kontrollieren Sie die Umgebungsbedingungen und halten Sie diese aufrecht, wenn Sie Ihre Proben abbilden
Es ist wichtig, dass Sie während des gesamten Lebendzell-Imaging-Experiments die richtigen Umgebungsbedingungen für Ihre Proben einhalten. Umgebungskontrollen umfassen Temperatur, Feuchtigkeit und Gas (d. h. Sauerstoff und Kohlendioxid).
Die Fähigkeit, eine stabile Temperatur zu regulieren und aufrechtzuerhalten, erhält nicht nur die Zellgesundheit, sondern reduziert auch das Risiko einer Fokusabweichung. Fokus-Drift ist die Unfähigkeit, den Fokus über die Zeit aufrechtzuerhalten. Dies ist in der Regel auf Temperaturschwankungen zurückzuführen, die zur Expansion und Kontraktion der zur Herstellung der Mikroplatte oder anderer Kulturbehälter verwendeten Materialien führen. Um das Risiko einer Fokusdrift aufgrund von thermischen Schwankungen weiter zu verringern, stellen Sie sicher, dass die Mikroplatte auf dem Instrumententisch oder in der Umgebungskontrollkammer sitzt, um eine thermische Äquilibrierung zu ermöglichen, bevor Sie die Aufnahmeeinstellungen konfigurieren. Wenn während des Zeitraffer-Experiments Medien zu den Wells hinzugefügt werden müssen, stellen Sie außerdem sicher, dass diese die gleiche Temperatur haben wie das Medium im Imaging-Behälter. Integrierte Kontrolloptionen für die Fluidik oder die Automatisierungsintegration mit Liquid Handlern für die Zugabe von Medien und Reagenzien erhöhen den Durchsatz und minimieren das Risiko einer Kontamination oder Störung der Zellen durch manuelle Eingriffe.

Die Aufrechterhaltung der richtigen Luftfeuchtigkeit hilft, die Verdunstung von Medien zu verhindern, insbesondere bei Langzeitexperimenten mit Lebendzellen. Verdunstung verursacht Veränderungen der Osmolarität, die sich negativ auf das Verhalten Ihrer Zellen und Ihren Assay auswirken können. Eine hypotone (niedrig gelöste) Lösung kann verwendet werden, wenn die Feuchtigkeitskontrolle nicht in Frage kommt.
Die Kontrolle des Kohlendioxidgehalts ist ebenfalls wichtig, da er bei der Regulierung des pH-Werts in Ihrer Probe hilft. Wenn Sie den Kohlendioxidgehalt nicht kontrollieren können, gibt es verschiedene synthetische Puffer, wie HEPES, die zur Aufrechterhaltung des pH-Werts verwendet werden können. Die Kompatibilität zwischen den zu untersuchenden Zellen und dem synthetischen Puffer sollte jedoch vor der Verwendung überprüft werden, da synthetische Puffer für viele Zelltypen schädlich sein können. Wenn die Zellen kompatibel sind, sollte HEPES für Kurzzeitstudien verwendet werden, die einige Stunden dauern, da eine längere Wartung in HEPES-gepufferten Medien schädlich für die Zellen sein könnte.
Die Aufrechterhaltung des richtigen Sauerstoffgehalts ist ebenfalls von entscheidender Bedeutung, da der Sauerstoffbedarf je nach Zelltyp oder den Anforderungen des jeweiligen Lebendzellexperiments stark variieren kann.
Imager wie das ImageXpress® Pico Automated Cell Imaging System und das ImageXpress® Confocal HT.ai High-Content Imaging System umfassen eine Vielzahl von Optionen zur Umgebungskontrolle für Temperatur, Feuchtigkeit, Sauerstoff und Kohlendioxid. Da diese Imager vollständig in ein geschlossenes Umgebungskontrollsystem integriert werden können, werden die Platten nicht Umgebungslicht und anderen Laborbedingungen ausgesetzt, die die Integrität der Probe beeinträchtigen könnten. Darüber hinaus ermöglicht Ihnen die Software des ImageXpress Systems die genaue Überwachung der zellulären Umgebung im Verlauf des Experiments mittels der Messwerte des Umgebungskontrollsensors.
3. Verwenden Sie bei der Bilderfassung robuste Autofokus-Modi
Unsere ImageXpress Systeme sind mit einer Vielzahl von Hardware- (Laser und LED) und Software-Autofokusmodi (bildbasiert) ausgestattet, die es Ihnen ermöglichen, Fokusbilder zwischen Experimenten zu finden und zu erhalten und die Fokusdrift zu minimieren. Die Autofokus-Modi eignen sich für ein breites Spektrum an Proben, Kultivierungsgefäßdicken, Objektiven und Imaging-Parametern.
Die Hardware-Autofokusmethoden funktionieren für die meisten Proben und sind unabhängig von der Probenqualität und -helligkeit. Der Hardware-Autofokus ermöglicht höhere Aufnahmegeschwindigkeiten und minimiert so die Photobleichung von Proben. Wenn die Z-Position der Probe im Laufe der Zeit oder über eine Platte hinweg variiert, kann das Hinzufügen von Software-Autofokus-Methoden dazu beitragen, eine zuverlässige Fokussierung über die gesamte Probe und das gesamte Labormaterial hinweg zu ermöglichen. In den meisten Fällen, in denen eine softwarebasierte Fokussierung erforderlich ist, sollte sowohl der Hardware- als auch der Software-Autofokus aktiviert sein. Der Hardware-Autofokus findet den Plattenboden, den Wellboden oder beide Oberflächen. Anschließend nutzt der Software-Autofokus den Bildkontrast, um die ideale Fokusebene zu finden. Daher sollten die Proben hell und frei von Schmutz sein, damit der Software-Autofokus optimal funktioniert.
Im Gegensatz zum Hardware-Autofokus verringert der Software-Autofokus die Aufnahmegeschwindigkeit und birgt das Risiko, dass Proben fotobleichen. Um dies zu vermeiden, sollte der Software-Autofokus für den ersten aufgenommenen Kanal aktiviert sein, und das Durchlicht kann anstelle eines Fluoreszenzkanals als dieser erste Kanal verwendet werden. Verkürzen Sie außerdem Ihre Expositionszeit und verwenden Sie hellere, stabilere Fluorophore. Werkzeuge wie das Binning (siehe Nr. 6) können auch zur Reduzierung der Expositionszeiten verwendet werden.
Software-Autofokus-Methoden sollten nur dann allein verwendet werden, wenn der Hardware-Autofokus nicht für Ihre Platte konfiguriert wurde, der Hardware-Autofokus aufgrund von Plattenfehlern fehlschlägt, das geringe Volumen in den Wells die Zuverlässigkeit des Hardware-Autofokus verringert oder wenn Ölimmersionsobjektive verwendet werden.
Mit der MetaXpress® High-Content Image Acquisition and Analysis Software können Anwender Autofokus-Einstellungen konfigurieren, um die Anforderungen eines bestimmten Assays zu erfüllen. Bei der Durchführung schneller kinetischer Zeitrafferexperimente in einem einzigen Well kann der Autofokus nur zum ersten Zeitpunkt angewendet werden, um die Aufnahmerate zu erhöhen. Für Langzeit-Zeitrafferexperimente oder wenn die Imaging-Rate unkritisch ist, kann der Autofokus auf alle Zeitpunkte eingestellt werden, um die Fokusdrift zu reduzieren.
In der CellReporterXpress® Bilderfassungs- und Analysesoftware können eine Vielzahl von Autofokus-Routinen für Hardware und Software aktiviert werden. Jedes Produkt wurde für spezifische Anwendungsfälle entwickelt und bietet unvergleichliche Fokussierungsoptionen für eine Vielzahl von Proben. So erkennt beispielsweise die Hardware-Autofokus-Routine für den Well-Einsatz drei Peaks (Plattenboden, Well-Boden und Well-Einsatz) für eine schnelle Erkennung und optimale Fokussierung für Laborgeräte, die drei verschiedene Oberflächen enthalten. Bei Aufnahmen, die eine höhere Geschwindigkeit bei geringer Vergrößerung erfordern, behält die Ankerfokuspositionsroutine die ausgewählte in-Fokus-Z-Position bei, deaktiviert den Autofokus und nimmt Bilder mit dieser gespeicherten Fokusposition auf. Dies ist besonders bei der Arbeit mit makroskopischen Proben wie ganzen Organismen oder Geweben hilfreich.
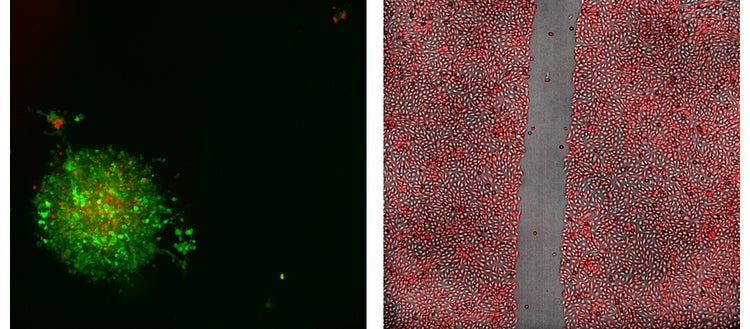
Links: Repräsentatives 20X konfokales 2D-Projektionsbild aus einem Immunonkologie-Assay, das ein Mauskolonkarzinom-Sphäroid zeigt; hergestellt aus GFP-exprimierenden MC38-Zellen, behandelt mit T-Zellen, die RFP exprimieren.
Rechts: 4X Wundheilungs-Assay-Bild von Sigma U2OS-Zellen, die stabil transfiziert wurden, um RFP zu exprimieren.
4. Minimieren Sie die Leistung der Lichtquelle und Ihre Belichtungszeit während der Bildaufnahme
Die Leistung Ihrer Lichtquelle und die Expositionsdauer können Phototoxizität Ihrer Zellen verursachen. Selbst kleine Veränderungen der Zellen können ihr Verhalten oder ihre Genexpression beeinflussen. Daher müssen Sie die richtige Balance finden, bei der Sie ein qualitativ hochwertiges Bild aufnehmen können, ohne Ihre Probe zu viel Licht auszusetzen.
In Bezug auf die Beleuchtung erzeugt ein Fluorophor oder Fluoreszenzmolekül freie Radikale, die DNA-Schäden verursachen und die Zellen belasten können. Je höher die Lichtintensität, desto höher der Anregungszustand, der zu Phototoxizität oder Zellschädigung führen kann. Ultraviolettes (UV) Licht ist bekanntermaßen phototoxisch, sodass die Verwendung anregbarer Fluorophore wie DAPI im Vergleich zur Verwendung grüner oder roter Fluorophore zu einer höheren Phototoxizität führen kann.
Wenn es um Fluoreszenz-Imaging oder Mehrfarben-Imaging geht, ist es am besten, photostabile und sehr helle Fluorophore mit hohem Signal-Rausch-Verhältnis und unterschiedlichen Emissionsspitzen zu verwenden. So können Sie Ihre Expositionszeit verkürzen. Das ImageXpress-System verfügt über Schmalband-Pass-Filterwürfel, um Crosstalk zu vermeiden. Es umfasst auch Hochleistungs-Lichtquellen, die abgeschwächt und gesteuert werden können. Das ImageXpress Confocal HT.ai System umfasst zum Beispiel eine Laser-Lichtquelle mit sieben Kanälen und acht Imaging-Kanälen, um mehrfarbige Etikettierungsexperimente wie Cell-Painting-Anwendungen zu ermöglichen.
Objektive mit hoher numerischer Apertur (NA), wie Wasserimmersionsobjektive, ermöglichen es Ihnen, hellere, hochauflösende Bilder bei kürzeren Expositionszeiten zu erzeugen. Bei der Verwendung von Objektiven mit hoher NA ist es vorzuziehen, dünne Kunststoff-Mikroplatten oder Kulturschalen (d. h. solche, die die Dicke eines Deckglases aufweisen) zu verwenden. Die Verwendung von Mikroplatten mit transparentem Boden und schwarzer Wand ist ebenfalls vorzuziehen, da sie weniger Autofluoreszenz erzeugen.
5. Verwenden Sie gegebenenfalls Bilddekonvolutionsalgorithmen, wenn Sie Weitwinkelmikroskopiesysteme verwenden
Weitwinkel-Mikroskopiesysteme wie das ImageXpress Pico System und das ImageXpress® Micro Confocal High-Content Imaging System eignen sich ideal für die Durchführung von Lebendzell-Imaging-Experimenten. Um die Auflösung oder Empfindlichkeit mit diesen Systemen zu erhöhen, können Bilddekonvolutionsalgorithmen verwendet werden. Die Bilddekonvolutionssoftware reduziert Licht außerhalb des Fokus während der Aufnahme, wodurch Sie die Expositionszeiten verkürzen und die Assayqualität erhalten können. Die Dekonvolution sollte jedoch genau und vorsichtig angewendet werden, um keine Artefakte zu erzeugen.
6. Verwenden Sie konfokale Imaging-Systeme, die die Verwendung von Hochleistungs-Laserlichtquellen und das Binning ermöglichen
Konfokale Mikroskopiesysteme wie das ImageXpress Confocal HT.ai System umfassen Laserlichtquellen, die am besten für das Imaging von 3D-Proben, dicken Proben oder schwachen Fluorophoren (z. B. fluoreszent markierte Proteine) geeignet sind. Mit den konfokalen Instrumenten können Sie die Laser- und LED-Lichtintensitätsleistung regulieren und steuern.
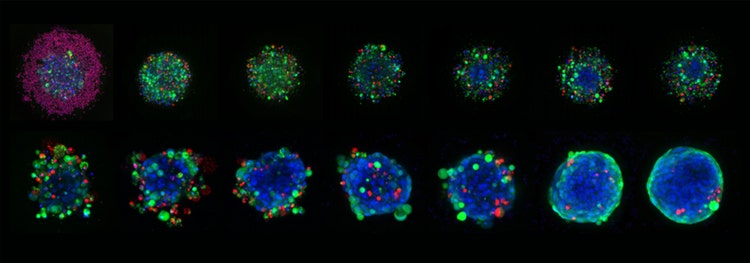
Repräsentative 10X Plan-Apo-Bilder von HCT116-Sphäroiden, die in Corning Elplasia-Mikrokavitätsplatten gezüchtet und insgesamt sechs Tage lang mit unterschiedlichen Staurosporinkonzentrationen behandelt wurden. Die Sphäroide wurden mit Hoechst 33342 (blau, Kerne), Calcein AM (grün, lebende Zellen) und Ethidium Homodimer-III (rote, tote Zellen) gefärbt.
Das Binning ist ein weiteres Werkzeug, das beim Imaging in Weitwinkel- oder Konfokalaufnahmen verwendet werden kann, wobei die Auswirkungen des Binnings beim Imaging mit konfokalen Instrumenten offensichtlicher sind. Da die Spinning-Disk-Konfiguration des konfokalen Systems die Lichtmenge begrenzt, die auf die Probe trifft, und Licht blockiert, das außerhalb des Fokus liegt, müssen Sie in der Regel längere Belichtungszeiten oder Licht mit höherer Intensität verwenden. Das Binden erspart die Notwendigkeit, dies zu tun, indem es das elektrische Ladungs- oder Intensitätssignal von benachbarten Pixeln kombiniert und eine Summierung der Pixelintensitäten in einer bestimmten Region erzeugt. Diese Zusammenfassung gibt Ihnen eine höhere Intensität. Im Wesentlichen erhöht das Binning das Signal-Rausch-Verhältnis im Bild und ermöglicht Ihnen so eine geringere Belichtungszeit und eine geringere Lichtintensität. Dies verringert jedoch die räumliche Auflösung. Auch hier geht es darum, das Gleichgewicht zwischen der Aufnahme eines qualitativ hochwertigen Bildes und der Erhaltung der Gesundheit Ihrer Probe zu finden.
7. Nutzen Sie eine leistungsstarke Analysesoftware, um reproduzierbare und aussagekräftige Daten zu erhalten
Anwendungen für das Lebendzell-Imaging erfordern die Fähigkeit, relevante und große Mengen quantitativer Daten aus großen und manchmal komplexen Bildern und Datensätzen zu extrahieren.
High-Content-Analyse (HCA)-Lösungen wie unsere MetaXpress und CellReporterXpress® Software umfassen robuste Analysealgorithmen, um Bilder präzise zu segmentieren und reproduzierbare Daten zu erzeugen. Sie umfassen vorkonfigurierte Analysemodule für eine Vielzahl von Lebendzellen-Imaging-Anwendungen. Mit dem Kundenmodul-Editor in der MetaXpress Software können individuellere Analysen durchgeführt werden.
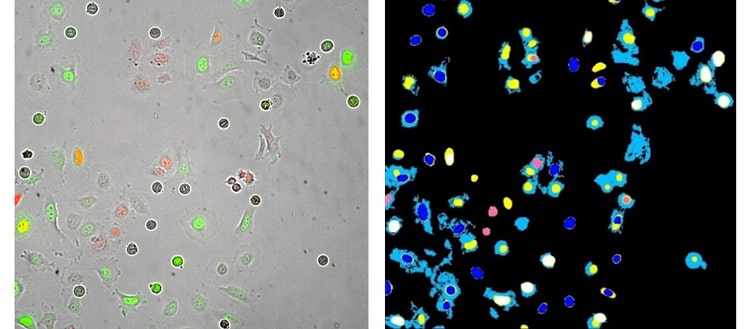
Links : 20X Plan Apo-Bild von HeLa-Zellen, die mit den Fucci-Zellzyklussensoren transfiziert wurden (GFP - Geminin und RFP-Cdt-1). Dieses Bild wurde 13 Stunden nach der Behandlung mit dem Zellzyklus-Inhibitor Noccodazol aufgenommen.
Rechts: Analysesegmentierungsmasken, die aus einer MetaXpress Custom Module-Analyse generiert wurden.
Wenn Sie mehr detaillierte Informationen über die untersuchten Zellen wünschen, können Algorithmen des maschinellen Lernens mit fortschrittlichen Datenanalysefunktionen verwendet werden. Unser IN Carta™ Image Analysis Software-Paket enthält geführte Arbeitsabläufe für maschinelles Lernen, um die Analysegenauigkeit zu verbessern und große Mengen heterogener Imaging-Daten zu sortieren und zu vergleichen.
Da Lebendzellen-Imaging-Experimente eine Menge Daten erzeugen, ist es von entscheidender Bedeutung, über eine ausreichende Speicherkapazität sowie eine ausreichende Verarbeitungsleistung für die Datenanalyse zu verfügen. Wie bereits erwähnt, kann das Binning die Bilddatengröße reduzieren und eine schnellere Datenübertragung ermöglichen, sodass Bilder schneller analysiert werden können. Das ImageXpress System umfasst zudem die MetaXpress® PowerCore™ High-Content Distributed Image Analysis Software, die parallele Verarbeitung nutzt, um die Analysegeschwindigkeit drastisch zu erhöhen.
Um mehr über die verschiedenen Anwendungen und Techniken zu erfahren, die für das Lebendzell-Imaging verwendet werden, besuchen Sie unsere Seite Lebendzell-Imaging.