
Nutzung von Mikroplatten-Assays für ein optimiertes Wirkstoffscreening mit hohem Durchsatz in der Krebsforschung
Inhalt
- High-Throughput-Screening in der Krebsforschung
- Mikroplatten-Assays für die Krebsforschung
- Nutzen Sie das Potenzial von Mikroplatten-Readern in der Krebsforschung
High-Throughput-Screening in der Krebsforschung
High-Throughput-Screening (HTS) hat das Gebiet der Krebsforschung revolutioniert, indem es die schnelle und systematische Evaluierung von Verbindungen auf ihr Potenzial als Krebswirkstoffe ermöglicht. Dieser Ansatz stellt einen entscheidenden Schritt in den frühen Stadien der Wirkstoffforschung von Krebs dar.
HTS umfasst die methodische Bewertung von Tausenden bis Millionen von Verbindungen aus Bibliotheken, um potenzielle Kandidaten zu identifizieren, die mit spezifischen biologischen Zielmolekülen auf vorhergesagte Weise interagieren. Diese Kandidaten, oft als „Leads“ oder „Treffer“ bezeichnet, dienen als Grundlage für die weitere Optimierung und Entwicklung potenzieller Krebsmittel.
Darüber hinaus wurden die jüngsten Fortschritte in der personalisierten Krebsbehandlung durch die Entwicklung gezielter Wirkstoffe vorangetrieben. Diese Behandlungen können Innovationen in der Organoid-Technologie nutzen, die die Kultur von Organoiden mit Selbsterneuerungskapazität, Selbstorganisation und langfristiger Proliferation nachahmen, während sie viele Eigenschaften von Primärgeweben nachahmen. Aus Patienten gewonnene Organoid(PDO)-Bibliotheken haben sich zu lebenden Biobanken entwickelt, die detaillierte Analysen der Gewebefunktion, Entwicklung, Tumorinitiierung und Krebspathologie ermöglichen. PDOs sind vielseitig einsetzbar und können für Sequenzierungsanalysen, Wirkstoffscreening, gezielte Therapietests, Tumor-Mikroumgebungsstudien und Gentechnikanwendungen verwendet werden.
Im Bereich der Krebsforschung werden diese Instrumente häufig eingesetzt, um die Auswirkungen von Verbindungen auf Krebszelllinien zu beurteilen, die Expression spezifischer Gene oder Proteine zu untersuchen und verschiedene zelluläre Antworten zu bewerten. Sie spielen eine entscheidende Rolle bei der Identifizierung potenzieller Krebswirkstoffe und fördern unser Verständnis der Krebsbiologie durch groß angelegte, systematische Screening-Bemühungen.
Roboter und Flüssigkeitshandhabungsgeräte sind für die Automatisierung von HTS von entscheidender Bedeutung. Diese Technologien ermöglichen die präzise Verteilung von Verbindungen, Zellen und Reagenzien in Multi-Well-Platten, wodurch Konsistenz gewährleistet und menschliche Fehler minimiert werden.
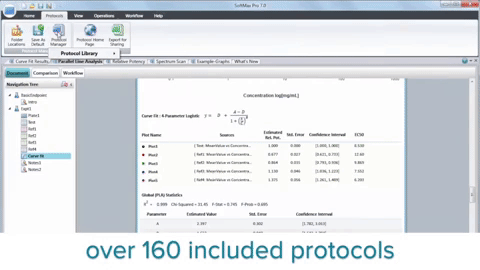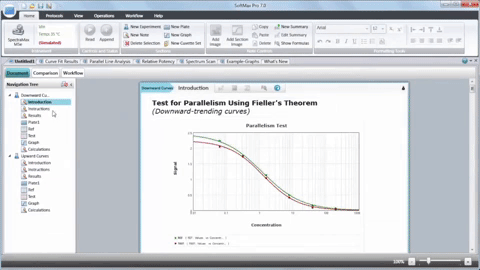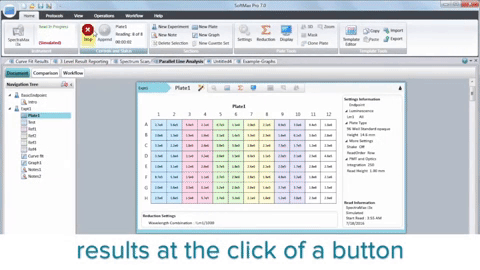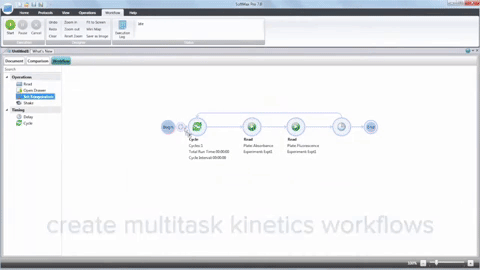
Zusammengefasst hat die Integration von Mikroplatten-Readern, 3D-Biologie, Robotik, Liquid Handling-Geräten und spezieller Software die Krebsforschung revolutioniert, indem sie die Entdeckung potenzieller Krebsverbindungen beschleunigt hat. HTS ist zwar kein Ersatz für den gesamten Wirkstoffforschungsprozess, spielt jedoch eine wichtige Rolle bei der Identifizierung von Elektroden und verbessert unser Verständnis der Krebsbiologie.
Mikroplatten-Assays für die Krebsforschung
Mikroplatten-Assays haben sich zu wertvollen Werkzeugen entwickelt, die Hochdurchsatzfähigkeiten und die Fähigkeit bieten, zahlreiche Proben gleichzeitig zu analysieren. Diese Assays ermöglichen es Forschern, verschiedene Aspekte der Krebsbiologie zu untersuchen, von der Zellviabilität und Zytotoxizität bis hin zu Protein-Protein-Interaktionen und Enzymaktivität. In diesem Artikel werden wir einige der wichtigsten Mikroplatten-Assays untersuchen, die in der Krebsforschung verwendet werden:
Zellviabilitäts-Assays
Zellviabilitäts-Assays werden verwendet, um die Anzahl der lebensfähigen und proliferierenden Zellen in einer Probe zu bestimmen. Sie sind entscheidend für die Beurteilung der Auswirkungen verschiedener Behandlungen auf Krebszellen und helfen Forschern, das Potenzial von Krebsmitteln zu bewerten. Übliche Methoden sind die Verwendung von Farbstoffen, die von lebenden Zellen aufgenommen werden, und das resultierende Signal wird mit einem Mikroplatten-Reader gemessen.
- Der MTT-Assay (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazoliumbromid) wird größtenteils in der Forschung zur Beurteilung der Überlebensfähigkeit und Proliferation von Zellen mit kolorimetrischen Messungen verwendet. Der gelbe MTT-Farbstoff wird durch metabolisch aktive Zellen zu einem violetten Formazan-Produkt reduziert (Abbildung 1). Diese wird gelöst und die Absorptionsintensität auf einem Mikroplatten-Reader bei 590 nm gemessen. Die MTT ist recht kostengünstig und relativ schnell, da sie innerhalb von vier Stunden Ergebnisse liefern kann. Auf dem Markt gibt es andere Mikroplatten-Assays, die ähnlich funktionieren, zum Beispiel wird gelbes XTT (2,3-bis-(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5-carboxanilid) durch metabolisch aktive Zellen auf orange Formazan (Absorptionsmessung, OD 450-500 nm) oder Resazurinfarbstoff (alamarBlue) auf Resorufin (Fluoreszenzmessung, ex 560 / em ) reduziert590.
Application Note lesen: Bestimmen Sie die Zellviabilität und Zellproliferation mit kolorimetrischen Messungen

Abbildung 1: Schematische Darstellung des Mechanismus des MTT-Assays
- Der ATP (Adenosintriphosphat)-Assay ist ein homogener, stabiler Lumineszenz-Assay zur Bestimmung der Anzahl lebender Zellen in einer Kultur. Die Methode basiert auf der Quantifizierung des im Well vorhandenen ATP, einem Indikator für metabolisch aktive Zellen (Abbildung 2). Mehrere Unternehmen verkaufen gebrauchsfertige Verbindungen, die im Verhältnis 1:1 mit den Proben in die Vertiefung gegeben werden müssen. Nach einer sehr kurzen Inkubation kann die Probe auf einem Mikroplatten-Reader mit Lumineszenz-Detektionsmodus abgelesen werden. Wie oben erwähnt, werden mehrere Tests in der Krebsforschung an 3D-Modellen durchgeführt. Die Durchführung eines Überlebensfähigkeitstests an Sphäroiden kann schwierig sein, da das Reagenz nur schwer den Kern des Sphäroids erreicht. Dennoch sind jetzt ATP-basierte Viabilitäts-Assays für 3D-Kulturen verfügbar, die es einfacher machen, das Ansprechen auf Arzneimittel sowohl in 2D- als auch in 3D-Modellsystemen schnell zu beurteilen.
Erfahren Sie mehr über ATP-Assays:

Abbildung 2: Schematische Darstellung des ATP-basierten Luciferin-Assay-Mechanismus
- Der EarlyTox™ Live/Dead Assay von Molecular Devices enthält zwei Marker für lebende oder tote Zellen: Calcein AM und Ethidium homodimer-III (EthD-III). Das nicht-fluoreszente Calcein-AM durchdringt die intakte Zellmembran und wird von intrazellulären Esterasen in fluoreszentes Calcein überführt. EthD-III ist praktisch nicht-fluoreszent und dringt bei intakter Plasmamembran nicht in die Zelle ein. Wenn die Integrität der Zellmembran beeinträchtigt wird (durch Zelltod), dringt EthD-III in die Zellen ein und bindet an Nukleinsäuren, was zu einer hellroten Fluoreszenz in toten Zellen führt (Abbildung 4).
Application Note lesen: Die Gesundheit von Zellen mit Zellviabilitäts-Assays auf dem SpectraMax iD3 Reader bestimmen
Zytotoxizitäts-Assays
In der Krebsforschung ist es von entscheidender Bedeutung zu verstehen, wie Zellen auf verschiedene Behandlungen ansprechen, einschließlich potenzieller Krebsmittel. Diese Mikroplatten-Assays können Forschern dabei helfen, zwischen apoptotischen (programmierter Zelltod) und nekrotischen (unkontrollierter Zelltod) Prozessen zu unterscheiden.
- Eine Vielzahl von Assays wurde entwickelt, um verschiedene Zelltodprozesse, einschließlich Apoptose und Nekrose, nachzuweisen und zu messen. In einem solchen Assay von Promega ermöglicht die Bindung zweier Annexin-V-Fusionsproteine, die komplementäre Untereinheiten der NanoBiT®-Luciferase enthalten, an exponiertes Phosphatidylserin auf der äußeren Broschüre von Zellmembranen während des apoptotischen Prozesses die Erzeugung eines Lumineszenzsignals. Bei Verlust der Membranintegrität dringt ein DNA-bindender Farbstoff in die Zelle ein und erzeugt ein grünes Fluoreszenzsignal (Abbildung 3).

Abbildung 3: In gesunden Zellen sind die Fusionsproteine Annexin V-LgBiT und Annexin V-SmBiT (NanoBiT) weit voneinander entfernt und es wird keine Lumineszenz erzeugt. Der profluoreszente DNA-Farbstoff bindet nicht an die DNA, und auch das Fluoreszenzsignal fehlt (A). In der frühen Apoptose bleibt die Lumineszenz niedrig, bis die PS-Exposition die Annexin-V-Fusionsproteine nahe zusammenbringt und eine funktionelle Luciferase bildet, während der profluoreszente DNA-Farbstoff außerhalb der Zellen verbleibt. Die Lumineszenz wird erzeugt, und die Fluoreszenz bleibt aus (B). Während der sekundären Nekrose wird ein Fluoreszenzsignal erzeugt, wenn die Membranintegrität während der Apoptose im Spätstadium verloren geht, wenn der DNA-Farbstoff in die Zelle eindringen kann. In diesem Fall werden sowohl Lumineszenz als auch Fluoreszenz erzeugt (C).
- Beim LDH-Assay (Lactatdehydrogenase) wird LDH in das Zellkulturmedium freigesetzt, wenn die Zellmembranen unterbrochen werden, wie bei toten oder absterbenden Zellen.
- Die Caspase-Aktivität wird mit einem fluorogenen Substrat gemessen, das Fluoreszenz nach Spaltung durch aktive Caspase emittiert. Entdecken Sie einen homogenen Single-Step-Assay für Caspase-3, der speziell für Mikroplatten-Reader konzipiert ist: Das fluorogene Substrat (Ac-DEVD)2-R110 enthält zwei DEVD-Konsensus-Zielsequenzen und wird von den Enzymen im Zelllysat vollständig hydrolysiert. Durch die Hydrolyse beider DEVD-Peptide wird der grüne Fluoreszenzfarbstoff R110 freigesetzt, was zu einem starken Anstieg der Fluoreszenz führt (Anregung bei 110 nm und Emission bei nm). Die EarlyTox Caspase-3/7 NucView Assay Kits ermöglichen den Nachweis der Apoptose in intakten Zellpopulationen durch die Verwendung des NucView Caspase-3-Substrats. Der Vorteil dieses Mikroplatten-Assays liegt darin, dass er für die Verwendung mit Mikroplatten-Readern und Imaging-Systemen optimiert wurde. Dieses Assay-Kit, das zusammen mit SpectraMax Mikroplatten-Readern oder dem SpectraMax MiniMax 300 Imaging Cytometer verwendet wird, bietet dem Anwender einen flexiblen Ansatz zur Quantifizierung der Apoptose. Apoptotische Zellen können direkt als Funktion der gesamten Fluoreszenz pro Well oder durch Imaging und Zählung einzelner Zellen gemessen werden, wobei die Ergebnisse für beide Methoden vergleichbar sind. Schließlich haben wir gezeigt, dass der EarlyTox Caspase-3/7 NucView™ 488 Assay auch bei Sphäroiden sehr gut funktioniert. Insbesondere untersuchten wir die Apoptose in magnetisch bioprinteten HepG2-Sphäroiden (Abbildung 4).

Abbildung 4: Schematische Darstellung verschiedener Optionen, die bei der Durchführung von Toxizitätsstudien mit den EarlyTox Cell Viability Kits verfolgt werden können.
Reportergen-Assays
Diese Mikroplatten-Assays beinhalten die Einführung von Reportergenen in Krebs oder andere Zelltypen, um die Aktivität bestimmter Gene oder Signalwege zu überwachen. Die Expression des Reportergens kann mithilfe von Mikroplatten-Readern quantifiziert werden, um Einblicke in die Regulation von krebsbedingten Genen und Signalwegen zu gewinnen. Einer der am häufigsten verwendeten Assays ist der Luciferase-Reporter-Assay, der die Untersuchung der Genexpression auf transkriptionaler Ebene ermöglicht. Sie ist beliebt, da sie relativ kostengünstig ist und schnelle, quantitative Messungen ermöglicht. Die Firefly-Luciferase ist ein weithin verwendeter Reporter zur Untersuchung der Genregulierung und Genfunktion. Aufgrund des Fehlens jeglicher endogener Luciferaseaktivität ist sie ein hochempfindlicher Reporter in Säugerzelllinien … Die Firefly-Luciferase katalysiert die ATP-abhängige Oxidation von D-Luciferin mit der resultierenden Lichtemission (Abbildung 1A). Luciferase aus der Meerespfanne Renilla reniformis wird häufig in Multiplex-Luciferase-Assays als zweiter Reporter zur Normalisierung der Transfektionseffizienz und zur Untersuchung der Genregulation und -funktion verwendet. Die Renilla-Luciferase katalysiert die Coelenterazin-Oxidation zur Erzeugung von Licht. Dual-Luciferase-Assays ermöglichen die Messung der Glühwürmchen- und Renilla-Luciferase-Aktivität in einer einzigen Probe, wobei Glühwürmchen als experimenteller Reporter und Renilla als Kontrolle fungieren (Abbildung 5).

Abbildung 5: Chemische Reaktionen, katalysiert durch Glühwürmchen-Luciferase (A) und Renilla-Luciferase (B).
Der SpectraMax® DuoLuc™ Reporter Assay Kit ermöglicht die hochempfindliche Quantifizierung der Glühwürmchen- und Renilla-Luciferasen in Säugerzellen. Die serielle Injektion von zwei optimierten Nachweisreagenzien ermöglicht die Assays der Luciferasen in demselben Mikroplatten-Well. Wir zeigen Ihnen, wie der DuoLuc Reporter Assay und der SpectraMax iD5 Reader verwendet werden, um den Nukleären Faktor κB (NF-κB) in einem Modell mit Säugetierzellen zu aktivieren. NF-κB ist sehr wichtig für die Regulierung von Entzündungen, Immunität, Proliferation, Differenzierung und Apoptose.
Erfahren Sie mehr über Dual-Luciferase-Reportergen-Assays:
- Überwachen Sie die Aktivierung von NF-κB auf dem SpectraMax iD5 mit einem sensitiven Dual-Luciferase Reporter Assay
- Erfassen Sie die Expression der Dual-Luciferase auf dem FlexStation 3 Mikroplatten-Reader
Enzymaktivitäts-Assays
Enzyme, wie Kinasen und Phosphatasen, spielen eine entscheidende Rolle in den Signalwegen von Krebs. Enzymaktivitäts-Assays umfassen die Messung der Aktivität dieser Enzyme mithilfe von Substraten, die ein nachweisbares Signal erzeugen. Mikroplatten-Reader quantifizieren die enzymatische Reaktion und ermöglichen es Forschern, die Auswirkungen verschiedener Behandlungen auf die Enzymaktivität zu bewerten.
- Die IMAP® Technology von Molecular Devices ermöglicht schnelle, homogene und nicht-radioaktive Assays für Kinasen, Phosphatasen und Phosphodiesterasen und ist sowohl für die Assay-Entwicklung als auch das High-Throughput-Screening geeignet. IMAP-Assays basieren auf der Bindung von Phosphat an immobilisierte Metall-Koordinationskomplexe auf Nanopartikeln. Wenn die IMAP-Bindungseinheit an ein phosphoryliertes Substrat bindet, verändert sich die molekulare Bewegung des Peptids und die Fluoreszenzpolarisation (FP) der an das Peptid gehefteten fluoreszierenden Markierung erhöht sich (Abbildung 1, links). In einer TR-FRET-Version des Assays ermöglicht die Einbindung eines Terbium (Tb)-Donors einen Fluoreszenzenergietransfer, der auftritt, wenn phosphoryliertes Substrat vorhanden ist (Abbildung 1, rechts). Die Detektion dieses Assays erfolgt im zeitaufgelösten Modus, der die Fluoreszenzinterferenz von Assaykomponenten oder Verbindungen in einem Screen virtuell beseitigt. Ein TR-FRET bietet auch Flexibilität hinsichtlich der Substratgröße und -konzentration.
Erfahren Sie mehr über IMAP-Assays:

Abbildung 6: Prinzip der IMAP-FP- und TR-FRET-Phosphodiesterase-Assays
- THUNDER™ ist eine vielseitige und kostengünstige zellbasierte Assay-Plattform, die von Bioauxilium Research zur Messung einzelner phosphorylierter und vollständig endogener Proteine entwickelt wurde. Insbesondere ist das THUNDER™ Phospho-ERK1/2 (T202/Y204) Assay-Kit ein homogener TR-FRET Sandwich-Immunoassay mit einem einfachen Arbeitsablauf, der aus drei Schritten besteht, die indirekt die höhere oder niedrigere Aktivität des Tyrosinkinase-Rezeptors vor dem MAPK/ERK-Zellsignalweg berichten können (Abbildung 8).
Application Note lesen: Zellbasierte Bestimmung der ERK1/2-Phosphorylierung mit dem THUNDER-TR-FRET-Assay

Abbildung 8 THUNDER TR-FRET Sandwich-Immunoassay. Die Bindung von Eu-Ab1 und FR-Ab2 an den Analyten ermöglicht einen Energietransfer vom Europiumchelat zum Akzeptorfluorophor, was zu einem Signal bei 665 nm führt, das mit einem Mikroplatten-Reader mit zeitaufgelöstem Detektionsmodus detektiert wird.
Protein-Protein-Interaktions-Assays
Forscher verwenden Mikroplatten-Reader, um Interaktionen zwischen spezifischen Proteinen in Krebswegen zu erkennen und zu quantifizieren. Diese Wechselwirkungen können die Rolle dieser Proteine bei der Krebsentwicklung und -progression aufdecken. Arzneimittelbehandlungen werden oft mit dem Ziel entwickelt, bestimmte Protein-Protein-Interaktionen zu unterbrechen. Daher ist es wichtig, Mikroplatten-Assays zu haben, die die Erforschung von Interaktionen zwischen spezifischen Proteinen erleichtern.
- BRET (Biolumineszenz-Resonanzenergietransfer) ist eine Technik zur Messung von Protein-Protein oder Protein-Ligand-Interaktionen, die die Interaktion eines biolumineszenten Donors und eines Fluoreszenz-Akzeptors einschließen. Wenn der Donor und der Akzeptor näher als 10 nm zueinander liegen, reizt der Donor den Akzeptor an, der dann Fluoreszenz emittiert. Indem ein Protein von Interesse mit dem Spender und seinem Bindungspartner mit dem Akzeptor markiert wird, kann man Proteininteraktionen messen, indem man einen Mikroplatten-Reader verwendet, um das vom Spender und Akzeptor emittierte Licht zu erkennen (Abbildung 9).
Erfahren Sie mehr über die NanoBRET-Technologie:

Abbildung 9: NanoBRET-Assay. Wenn eine NanoLuc-Protein-A-Fusion (Energiespender) mit einer fluoreszent markierten HaloTag-Protein-B-Fusion (Energieakzeptor) interagiert, werden Spender und Akzeptor nahe beieinander gebracht und Energie übertragen.
- Es steht eine große Vielfalt an Toolbox-Reagenzien und Kits zur Verfügung, um sich mit Protein-Protein-Interaktionen, nukleären Rezeptorassays, Rezeptordimerisierung, Ligandenbindung, Rezeptorinternalisation, Enzymassays und mehr zu befassen. Die HTRF schließt die Verwendung von zwei Fluorophoren mit ein, einem Donor und einem Akzeptor, um Proteine und andere zu untersuchende Biomoleküle zu markieren. Wenn die Biomoleküle interagieren, ermöglicht ihre räumliche Nähe einen Fluoreszenz-Resonanzenergietransfer (FRET), der vom Fluorophor des Donors zu dem des Akzeptors stattfindet. Die Verwendung lang anhaltend fluoreszenter Lanthanoid-Kryptate als Donoren ermöglicht HTFR-Assays mit zeitaufgelöster Detektion und minimiert die kurzlebige Hintergrundfluoreszenz von Verbindungen und anderem Material. Die Detektion eines zeitaufgelösten (time-resolved) FRET (TR-FRET) mit einem Mikroplatten-Reader ermöglicht die Messung biomolekularer Bindungen. (Siehe auch IMAP TR-FRET oben.)
- Die Fluoreszenzpolarisation (FP) ist eine Technik, die weitverbreitet angewendet wird, um Bindungsereignisse in Lösungen zu überwachen. Es kann zur Beurteilung der Protein-Antikörper-Bindung, DNA-Hybridisierung und Enzymaktivität verwendet werden und eignet sich gut für das High-Throughput-Screening. Ein kleines, fluoreszenzmarkiertes Molekül (Tracer), der mit linear polarisiertem Licht angeregt wurde, emittiert hauptsächlich depolarisiertes Licht, da der Tracer in der Zeit zwischen Anregung und Emission schnell rotiert. Wenn der Tracer jedoch ein wesentlich größeres Molekül bindet, rotiert er langsamer und das emittierte Licht bleibt zum größten Teil polarisiert. Die Menge an polarisiertem/depolarisiertem Licht liefert eine Quantifizierung der Interaktion zwischen dem Protein und dem Tracer. (Siehe auch IMAP FP oben.)
Application Note lesen: Etablierung und Optimierung eines Fluoreszenzpolarisationsassays
ELISA (Enzyme-Linked Immunosorbent Assay)
ELISAs werden in der Krebsforschung häufig zur Quantifizierung von Proteinen eingesetzt. Mikroplatten-Reader messen die in diesen Assays erzeugten Signale, um die Konzentration spezifischer Proteine, wie Zytokine oder Wachstumsfaktoren, zu bestimmen, die oft für die Krebsbiologie relevant sind
Erfahren Sie mehr über ELISAs, indem Sie unser E-Book herunterladen, ELISA erklärt: von den Grundlagen bis zur praktischen Anwendung.
AlphaScreen/AlphaLISA
AlphaLisa ist ein auf Beads basierender, homogener Assay zur Untersuchung molekularer Interaktionen im Mikroplattenformat. Im Vergleich zu herkömmlichen ELISA-Methoden, die mehrere Waschschritte haben, die Zell-Monolayer beschädigen können und sehr zeitaufwendig sind, erfordert AlphaLISA keine Waschschritte, wodurch der Zellverlust minimiert wird, was zu schnelleren und genaueren Ergebnissen führt.
Application Note lesen: AlphaLISA Screen auf der SpectraMax Paradigm Multi-Mode Mikroplatten-Detektionsplattform
TR-FRET (einschließlich HTRF)
HTRF® ist eine vielseitige Technologie, die von Cisbio zum Nachweis biomolekularer Interaktionen entwickelt wurde. HTRF®, eine von Cisbio entwickelte Assay-Technologie, kombiniert Standard-FRET (Fluoreszenz-Resonanzenergietransfer) mit zeitaufgelöster Messung der Fluoreszenz, wobei kurzlebige Hintergrundfluoreszenz unterdrückt wird.
Application Note lesen: HTRF-Human-TNFα-Assay auf dem SpectraMax Paradigm Multi-Mode-Mikroplatten-Reader
Der Assay verwendet Donor- und Akzeptor-Fluorophore. Wenn Spender und Akzeptor nahe genug beieinander liegen, löst die Anregung des Spenders durch eine Energiequelle (z. B. eine Blitzlampe) einen Energietransfer zum Akzeptor aus, der wiederum spezifische Fluoreszenz bei einer bestimmten Wellenlänge emittiert. HTRF wird auch häufig als Ersatz für klassischen ELISA verwendet, da es eine einfache, waschfreie Strategie zum Nachweis und zur Quantifizierung von Proteinen in nur zwei Stunden bietet. Darüber hinaus verfügt sie über einen breiten nachweisbaren Bereich und ist mit langer Signalstabilität skalierbar.
Application Note lesen: HTRF-Zytokin-Assays auf Überlebensfähigkeit von Zellen normalisieren
Reaktive Sauerstoffspezies (ROS)
ROS sind mit oxidativem Stress und Krebsentwicklung assoziiert. Mikroplatten-Reader können die ROS-Konzentrationen quantifizieren und Forschern helfen, den oxidativen Zustand von Krebszellen und ihren Beitrag zur Krebsprogression zu verstehen.
Application Note lesen: Messung reaktiver Sauerstoffspezies mit SpectraMax Microplate Readern
Zellzyklusanalysen
Die Zellzyklusanalyse ist eine wichtige Studie, die in der Krebsforschung häufig erforderlich ist. In der Regel wird sie mittels Durchflusszytometrie durchgeführt. Dennoch kann der SpectraMax® i3x Multi-Mode Mikroplatten-Reader, der mit dem SpectraMax® MiniMax™ 300 Imaging Cytometer ausgestattet ist, verwendet werden, um Bilder von FUCCI (fluoreszenter Ubiquitinations-basierter Zellzyklusindikator)-Sphäroiden abzubilden und zu analysieren. FUCCI-Sphäroide wurden entwickelt, um die Progression des Krebszellzyklus zu untersuchen, da sie die Identifizierung von Zellen in verschiedenen Phasen des Zellzyklus ermöglichen. Die FUCCI-Technologie basiert auf der Überexpression der Zellzyklus-abhängigen Proteine Geminin bzw. Cdt1, die jeweils mit einem grünen Fluorophor und einem roten Fluorophor fusioniert sind. Die Cdt1- und Genin-Konzentrationen schwanken während des Zellzyklus unterschiedlich: Die Cdt1-Konzentrationen erreichen in der G1-Phase ihren Höhepunkt, während die Gemininspiegel in der späten S-, G2- und M-Phase steigen. Dies führt dazu, dass der Kern der FUCCI-exprimierenden Zellen in der G1-Phase rot und in der späten S-, G2- und M-Phase grün erscheint (Abbildung 10). Obwohl dieser Assay nicht für HTS-Screenings indiziert ist, ist er ein wichtiger Mikroplatten-Assay, der durchgeführt werden kann, sobald Verbindungselektroden für eine weitere und tiefere Beschreibung ausgewählt wurden.
Application Note lesen: Bilderfassung und -analyse von FUCCI-Spheroiden auf dem SpectraMax MiniMax Zytometer

Abbildung 10: FUCCI-Zellzyklusanalyse. mCherry-Cdt und AmCyan-Geminin fluoreszent markierte Zellzyklusproteine werden in verschiedenen Phasen des Zellzyklus exprimiert oder abgebaut, sodass die Zellen während der G1-Phase rot und während der S-, G2- und M-Phasen grün erscheinen. Zelluläres Imaging kann verwendet werden, um den Zellzyklus unter verschiedenen experimentellen Bedingungen zu überwachen.
Nutzen Sie das Potenzial von Mikroplatten-Readern in der Krebsforschung
Trotz erheblicher Fortschritte beim Verständnis der molekularen und zellulären Basis von Krebs gibt es noch viel zu erfahren über die Ursachen, das Fortschreiten und die potenziellen Behandlungen.
Wir haben dieses E-Book entworfen, um einen aufschlussreichen und umfassenden Überblick über die Rolle von Mikroplatten-Readern in der Krebsforschung und -entwicklung zu geben.
