
Organoid-Experten diskutieren: Die Komplexität und Vorteile des 3D-Imaging in der Organoidforschung
Die Humanbiologie ist komplex, und die komplizierten Maschinen hinter vielen biologischen Prozessen und Krankheiten wurden noch nicht vollständig aufgedeckt. Da 2D-Modelle diese Komplexität nicht nachahmen, können sie uns nur dabei helfen, die Oberfläche zu zerkratzen. Das Fehlen robuster Werkzeuge zur Vorhersage der Wirksamkeit und Sicherheit von Wirkstoffen ist einer der Gründe, warum über 90% der aktuellen Wirkstoffkandidaten klinische Studien nicht bestehen (1). Das 3D-Imaging bietet durch die Bereitstellung relevanterer und genauerer Modelle das Potenzial, dies zu verbessern – das 3D-Imaging birgt jedoch auch seine eigenen einzigartigen Herausforderungen, die für einen optimalen Erfolg überwunden werden müssen.
In einem neuen Podcast mit Drug Target Review diskutieren Dr. Hilary Sherman (Senior Applications Scientist bei Corning Life Sciences) und Dr. Oksana Sirenko (Senior Manager of Assay Development bei Molecular Devices ), wie 3D-Imaging-Technologien die Lücken in der Visualisierung und Analyse komplexer Zellmodelle schließen können.
Hilary und Oksana verfügen beide über umfangreiche Erfahrung in der Entwicklung und Verwendung von 3D-Zellmodellen. Sie diskutieren die Vorteile, die Organoide bei der Nachahmung und Vorhersage der Humanbiologie und ihrer Antworten haben, sowie die Herausforderungen, die mit dem Imaging und der Analyse dieser Proben einhergehen können.
Warum 3D statt 2D?
Humangewebe, Organe und Tumoren sind keine flachen 2D-Strukturen, sondern eher komplexe 3D-Assemblagen, die aus vielen verschiedenen Zelltypen bestehen. Darüber hinaus finden lebenswichtige biologische Prozesse wie Nährstoff- und Wirkstoffaufnahme, pH-Gradienten, Signaltransduktion, Abfallentsorgung und Zell-Zell-Interaktionen in einem 3D-Kontext statt. Diese Phänomene können die Zellbiologie und die Wirkmechanismen von Wirkstoffen erheblich beeinflussen, doch herkömmliche 2D-Zellmodelle erfassen diese Komplexität kaum, wenn überhaupt. Arzneimittel und Behandlungen, die in einem 2D-Kontext eine gute Leistung erbringen können, erzeugen daher nicht die gleiche Wirksamkeit, wenn sie in vivo verwendet werden. Diese Trennung zwischen der 2D- und der 3D-Umgebung erklärt teilweise, warum viele im Labor vielversprechend erscheinende Medikamente in klinischen Studien scheitern. Durch die Konstruktion von 3D-Systemen können wir biologisch relevantere Zellmodelle erstellen, die die Auswirkungen eines Medikaments oder einer Behandlung in der „realen Welt“ besser nachahmen.
Vorteile von Organoiden gegenüber anderen 3D-Zellmodellen
Organoide bieten zudem Vorteile gegenüber anderen gebräuchlichen 3D-Zellmodellen.
Organoide unterscheiden sich von Sphäroide, da sie strukturierter und anspruchsvoller sind. Während Sphäroide Cluster aus einem oder zwei Zelltypen umfassen, werden Organoide aus Vorläuferzellen (d. h. Stammzellen) gewonnen, die sich in mehrere Zelltypen differenzieren, um ein tatsächliches Organmodell zu erstellen. Die Ausrichtung der verschiedenen Zelltypen in Organoiden stellt das Organ im Körper in Bezug auf die Polarität oder das Lumen – das hohlraumartige Zentrum des Organs – besser dar. Wissenschaftler kapseln Organoide oft mit extrazellulärer Matrix oder Kollagen ein, um Zell-Zell-Interaktionen und die richtige Ausrichtung besser zu demonstrieren. Organoide eignen sich daher hervorragend zur Simulation der Funktionalität eines bestimmten Gewebes oder Organs.
Wenn es um die Darstellung komplexer menschlicher Gewebe und Organe geht, gehen Organoide und Organ-on-a-Chip unterschiedliche Ansätze ein, obwohl das Endziel ähnlich ist. Organ-on-a-Chip erfordert umfassende Kenntnisse des Organs und seiner Umgebung, die für ein funktionelles und kontrolliertes Design untersucht werden. Im Gegensatz dazu können Organoide aufgrund der Fähigkeit von Stammzellen, sich intrinsisch selbst zu organisieren und sich zu funktionellen Zelltypen zu differenzieren, einfacher gestaltet werden.

Lungen-Organoide
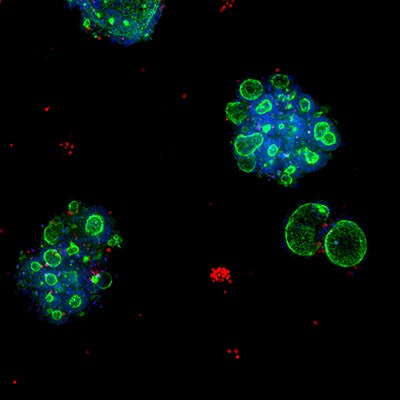
Kolorektale Organoide
Können Organoide in der personalisierten Medizin verwendet werden?
Die oben beschriebenen Eigenschaften von Organoiden machen sie zu idealen Kandidaten für die personalisierte Medizin, insbesondere für Erkrankungen mit mehreren Varianten, bei denen es kein einziges Medikament gibt, das für alle Patienten wirkt. Viele Krebs-Subtypen, wie dreifach-negativer Brustkrebs, fallen in diese Kategorie, wobei die chemotherapeutische Reaktion von Patient zu Patient erheblich variiert. Durch die Gewinnung von Organoiden aus Patientenbiopsien können Wissenschaftler von Patienten stammende Organoide (Patient-Derived Organoids, PDOs) erzeugen, die auch als Tumoroide bezeichnet werden. Dies ermöglicht es ihnen dann, die Wirkung verschiedener Verbindungen auf diesen spezifischen Tumortyp zu bewerten, was es ihnen letztendlich ermöglicht, das Ansprechen der Person auf die Behandlung besser vorherzusagen.
Komplexität von Organoiden
Laut Hilary müssen trotz standardisierter Arbeitsabläufe für die Entwicklung von Organoiden viele Faktoren bei der Arbeit mit Organoiden berücksichtigt werden. „Die Arbeit mit Sphäroiden ist ganz einfach, da man Platten ähnlich wie bei der Herstellung von 2D-Zellkulturen verwenden kann. Wenn man mit Organoiden arbeitet, wird der Arbeitsablauf aufgrund verschiedener Medienformulierungen und der Notwendigkeit teurer Reagenzien wie Wachstumsfaktoren viel komplexer.“
Eine weitere Anforderung ist die Verwendung der Corning® Matrigel® Matrix als extrazelluläre Matrix (ECM), die für die Bestimmung der Integrität oder Polarität des Organoids verantwortlich ist. Aufgrund seiner schwankenden physikochemischen Eigenschaften bei verschiedenen Temperaturen ist es jedoch ein schwieriges Material, mit dem man arbeiten kann, was nicht nur Probleme bei der Handhabung von Flüssigkeiten mit sich bringt, sondern auch zusätzliche Optimierungen bei der Abbildung der 3D-Struktur erfordert.
Jeder Organoidtyp birgt aufgrund der Variabilität der Arbeitsabläufe einzigartige zusätzliche Komplexitäten. Obwohl viele Arbeitsabläufe damit beginnen, induzierte pluripotente Zellen (iPCSs) in Vorläuferzellen zu differenzieren, können die nachfolgenden Schritte je nach Vorläuferzelltyp (z. B. Herz, Neuronen, Leber oder Darm) unterschiedlich sein. Zum Beispiel erfordern zerebrale (Hirn-)Organoide die Übertragung von iPCS auf ein neuronales Induktionsmedium, bevor sie in die Matrigelmatrixtröpfchen übertragen werden. Ein weiteres Beispiel ist der intestinale/rektale Organoid-Arbeitsablauf, bei dem die rektalen Organoide in mikrogemusterten Gri3D ® U-Boden-förmigen Mikrowells im Hydrogel für eine erhöhte Komplexität kultiviert werden.

Konfokale Bilder mit starker Vergrößerung von menschlichen Rektalorganoiden, die proinflammatorischen Zytokinen ausgesetzt waren. 40X-Bilder in einer Ebene von F-Actin (magenta) und DAPI (blau). 40X Einzelebenenbilder von F-actin (magenta) und DAPI (blau).
Herausforderungen bei Imaging und Bildanalyse
Zusätzlich zu den Komplexitäten der 3D-Zellbiologie können beim Imaging dieser Modelle auch Herausforderungen auftreten. Es kann für die Färbereagenzien schwieriger sein, die Struktur zu durchdringen, und das Fehlen ausreichender Lichtinfiltration und des richtigen Fokus kann das genaue Imaging beeinträchtigen
Bei der Arbeit mit komplexen 3D-Organoiden müssen Wissenschaftler die Penetration von Reagenzien in das Zellmodell berücksichtigen. Aus diesem Grund können zusätzliche Überlegungen erforderlich sein, wie z. B. die Erhöhung der Permeabilisierungspufferkonzentration, die Verlängerung der Inkubationszeit oder die Erhöhung der Antikörperkonzentration.
Oksana betont die Bedeutung längerer Färbe- und Fixierzeiten: „Während eine halbe Stunde für eine 2D-Kultur ausreicht, müssen wir Organoide mindestens zwei Stunden lang mit der Färbung inkubieren. Die Reparatur muss auch mindestens zwei Stunden lang, idealerweise über Nacht, durchgeführt werden.“
Die Imaging-Modalität ist ein weiterer entscheidender Faktor, und sowohl Licht außerhalb des Fokus als auch die Lichtpenetration können bei der Bildgebung von Organoiden eine Herausforderung darstellen. Zusätzliche Funktionen können jedoch die Bildqualität verbessern. Die Wasserimmersionstechnologie trägt beispielsweise dazu bei, sowohl die Auflösung als auch die Empfindlichkeit bei verschiedenen Vergrößerungsstufen zu erhöhen, indem eine Wasserschicht zwischen dem Objektiv und der Probe platziert und letztendlich schärfere Bilder erzeugt werden.
Die Organoide sind dick, daher muss die Lichtquelle über eine ausreichende Beleuchtungsleistung verfügen, um die Bildauflösung zu verbessern und die Aberration zu minimieren. Dennoch erfordert das Erreichen der gewünschten Helligkeit bei Standard-LED-Licht lange Aufnahmezeiten, die zu einer verringerten Bildintensität und einer möglichen Photobleichung führen können. Moderne konfokale Imager, wie das ImageXpress® Confocal HT.ai High-Content Imaging System, nutzen eine Multichannel-Laserquelle hoher Intensität, um die Assay-Empfindlichkeit zu erhöhen und Expositionszeiten zu minimieren.
Und schließlich ist ein zuverlässiger Fokus ein entscheidender Aspekt bei der Bildgebung von Organoiden, um verschiedene Detaillierungsgrade zu erfassen, ohne die Auflösung zu beeinträchtigen. Darüber hinaus können Forscher durch die Kombination von konfokalem High-Content-Imaging mit robuster Bildanalysesoftware umfassende phänotypische Profile erstellen, die Größe, Fläche, Volumen, Dichte, interzelluläre Distanz und subzelluläre Strukturen umfassen.
Eine weitere signifikante Herausforderung während der Bildanalysephase ist die Komplexität und Heterogenität von Organoidobjekten und Phänotypen, die eine Herausforderung für die Analyse darstellen. Die Analysemethoden ermöglichen die Charakterisierung von Objekten mithilfe mehrerer Auslesevorgänge, einschließlich Volumina, Flächen, Intensitäten, ermöglichen auch die Zählung und Charakterisierung von Zellen und sogar subzellulärer Strukturen innerhalb von Organoiden. Fortgeschrittene Analysewerkzeuge, darunter Elemente des maschinellen Lernens, um Informationen über Organoid-Phänotypen und Veränderungen der Phänotypen infolge verschiedener Behandlungen abzuleiten.
Zukunft der Organoidentwicklung und des Imaging
Mit der Geschwindigkeit, mit der Organoidprotokolle entwickelt werden und Imaging-Technologien voranschreiten, ist der nächste wichtige Schritt in der Organoidforschung die Integration der Automatisierung in Labore, um die Workflow-Geschwindigkeit zu verbessern und die Reproduzierbarkeit zu erhöhen. Laut Oksana befinden sich End-to-End-Lösungen zur Workflow-Automatisierung in den Kinderschuhen.
„Zuvor haben wir uns auf die Automatisierung von Imaging und Bildanalyse konzentriert, aber der nächste Schritt ist die Fähigkeit, den gesamten Arbeitsablauf zu automatisieren. Dazu gehört die Automatisierung aller Teile der gesamten Zellreise: Liquid Handler, Inkubator, Zentrifuge, Plattenreader – alle durch ein Robotersystem miteinander verbunden, das nahtlos zwischen den einzelnen Komponenten navigieren kann. Der Roboterarm kann die Platten zur Medienzugabe, Zellplattierung und Färbung vom Inkubator zum Pipettierroboter bewegen. Anschließend können die Platten für die High-Content-Analyse in das Imaging-System und die Analysesoftware übertragen werden.“
Ein Beispiel für ein solches automatisiertes System ist das Organoid Innovation Center von Molecular Devices – eine End-to-End-Lösung, die den Entwicklungsprozess von Organoiden mit Zellkultur, Behandlung und Inkubation bis hin zu Imaging, Analyse und Datenverarbeitung standardisiert.
Neben der Automatisierung ist die anfängliche Optimierung ein weiterer Faktor, der den Erfolg der Organoid-Studie bestimmt. Hilary erklärt: „Je mehr Zeit mit der Optimierung des Organoid-Forschungsprozesses im Vorfeld verbracht wird, indem die Biologie und Struktur des spezifischen Organoidtyps verstanden wird, desto robuster werden die Datenerfassung und -analyse sein und desto besser werden die bildbezogenen Daten sein.“
Wenn es um die Wirkstoffforschung und das Krankheitsmodell geht, wächst die Organoidforschung schnell und verspricht viel. Bei der Erforschung der Optionen für Ihr Labor ist es wichtig, angemessene Untersuchungen und Ressourcen zu investieren, um einen optimierten Arbeitsablauf zu entwickeln, der reproduzierbare, zuverlässige und genaue Ergebnisse liefert. Wenn sie optimal durchgeführt werden, können Forscher von erhöhter Produktivität, verbesserter Effizienz, schnellerer Markteinführung und vor allem verbesserter Lebensqualität für Patienten profitieren.
Wenden Sie sich noch heute an einen unserer Experten, um zu erfahren, wie wir Sie bei der Optimierung Ihres Arbeitsablaufs in der 3D-Biologie oder Organoide unterstützen können.
- Mullard, Ascher. „Verschiedene klinische Erfolgsraten.“ Nature Reviews Drug Discovery 15,7 ( 2016): 447–448.