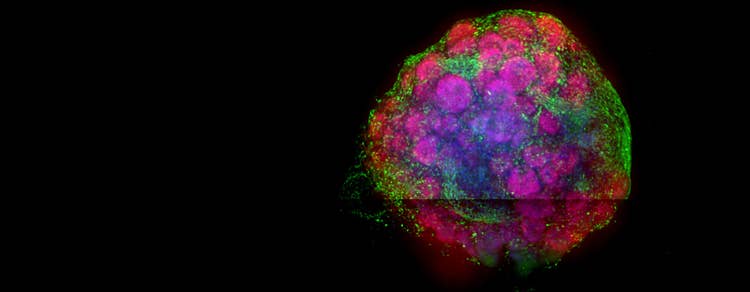
Gehirn-Organoide
Organoidtechnologie zum Verständnis der Entwicklung des Gehirns und neuronaler Erkrankungen
Gehirn-Organoide
Gehirnorganoide sind 3D-Gewebemodelle, die aus humanen induzierten pluripotenten Stammzellen (hiPSCs) erzeugt werden. Wenn Stammzellen kultiviert werden, differenzieren sie sich zu verschiedenen neuronalen Zellen, die mit der Zeit reifen und dann Strukturen von Gehirnregionen wie dem Vorderhirn (Prosencephalon) oder dem Mittelhirn (Mesencephalon) ähneln.
Die Kultivierung komplexer Organoide wie Gehirnorganoide ist eine sich rasch entwickelnde Technologie, die ein immenses Potenzial in Bereichen der Entwicklungsneurobiologie und Neurodegeneration besitzt. Jüngste Fortschritte haben die Kultivierung von Gehirnorganoiden aus iPSCs ermöglicht, wodurch die Erforschung der kortikalen Entwicklung und der damit verbundenen Krankheiten ermöglicht wird. Weitere Arbeiten sind erforderlich, bevor Gehirnorganoide in großem Maßstab für Studien zur funktionellen Genomik, in der Wirkstoffforschung und für die Untersuchung der durch Verbindungen hervorgerufenen Toxizität eingesetzt werden können.
Allgemeine Schritte zur Entwicklung von aus iPSCs erzeugten Gehirnorganoiden
Die Gehirnorganoide wurden nach dem Protokoll von Lancaster und Knoblich, 2014, gezüchtet. Bei dieser Methode werden die Gehirnorganoide in einem Kulturmedium gezüchtet, das die Selbstorganisation und die Ausbildung von Gewebemustern fördert.
- Tag 0 – Bildung von Embryoid Bodies (EB) – die iPSC-Zellen wurden in eine 96-Well-Platte mit äußerst geringer Anhaftung ausgesät.
- Tag 2–5 – Differenzierung der Keimschicht – füttern und überwachen der EBs.
- Tag 5 – Induktion der Neuronenbildung – Überführung in eine 24-Well-Platte mit Neuronen-Induktionsmedium.
- Tag 7 – Übertragung auf Matrigeltröpfchen – neuroektodermale Gewebe werden auf Matrigeltröpfchen übertragen.
- Tag 8–10 – Auswachsen der Neuroepithelknospen – das Auswachsen der Neuroepithelknospen verstärkt sich und sie umgrenzen flüssigkeitsgefüllte Lumen.
- Tag 11 – Reifung – die Gewebe werden in einen Spin-Bioreaktor überführt, um das Wachstum und das Auswachsen zu fördern.
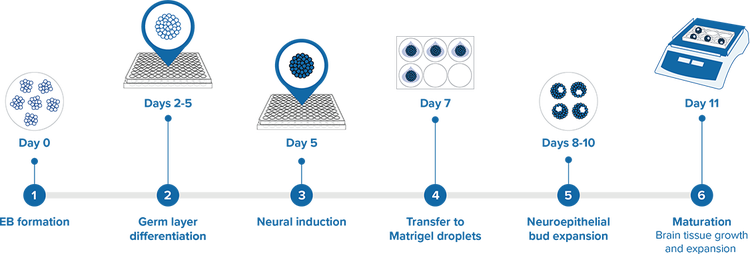
Die wichtigsten Schritte zur Erzeugung von aus iPSCs erzeugten Gehirnorganoiden. Das verwendete Protokoll geht auf Lancaster et. al. zurück und verwendet Medien von STEMCELL Technologies.
Überwachung der Entwicklung von 3D-Gehirnorganoiden mit Hilfe KI-basierter Analysewerkzeuge
Die sich entwickelnden Gehirn-Mikrogewebe können mit Hilfe KI-basierter Analysewerkzeuge wie unserer IN Carta® Bildanalyse-Software auf ihre Größe und Morphologie hin untersucht werden, um die Größe und Form der Gewebe zu bestimmen. Ausgewählte Mikrogewebe wurden während verschiedener Entwicklungsphasen mit Hilfe des konfokalen Imaging auf ihre zelluläre Organisation mittels der Expression unterschiedlicher neuronaler Marker untersucht.
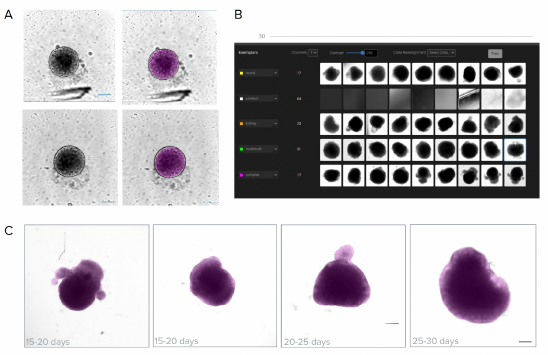
Abbildung 2: Analyse von Hellfeldaufnahmen mittels Deep-Learning-basierter Segmentierung. A) Die EBs wurden auf ihre Größe hin kontrolliert, bevor der Schritt der Neuroneninduktion eingeleitet wurde. Gezeigt sind Beispiele von Aufnahmen und deren entsprechenden Segmentierungsmasken, die mit der SINAP-Anwendung der IN Carta Software erstellt wurden. B) Das Histogramm zeigt die Verteilung der Durchmesser der EBs. Selektierte Größe = 10 μm C) Die Reifung der Organoide kann mittels Hellfeld-Imaging überwacht und mit der IN Carta SINAP-Anwendung analysiert werden. Maßstabsbalken = 100 μm.
Calcium-Imaging von Gehirnorganoiden zur Bestimmung der neuronalen Aktivität
Zum Nachweis funktioneller Aktivitäten wurden die Organoide mit einem calciumempfindlichen Farbstoff beladen. Anschließend wurden die Ca2+-Oszillationen mit dem ImageXpress® Confocal HT.ai High-Content Imaging System aufgezeichnet und mit der MetaXpress® Software zur High-Content-Bilderfassung und -analyse auf kinetische Peaks hin analysiert. Wir zeigen, dass das High-Content-Imaging in Kombination mit KI-basierter Analyse ein vielversprechendes Werkzeug für das Verbindungsscreening und die Toxizitätsbeurteilung in 3D-Gehirn-Organoiden ist.
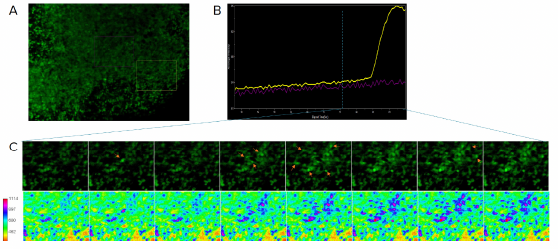
Abbildung 3: Synchrone Calciumaktivität in Woche 13. A) Das Bild zeigt einen optischen Ausschnitt aus einem mit Calcium-6 beladenen Organoid. B) Die Calciumintensität in der eingerahmten Region ist als durchschnittliche Intensität im zeitlichen Verlauf dargestellt. C) Vergrößerte Ansicht der in (A) eingerahmten Region im zeitlichen Verlauf. Die Pfeile weisen auf eine verstärkte Intensität hin. Die unteren Bilder zeigen die Calciumintensität in Form einer Wärmekarte. Beachten Sie die Ausbreitung der Intensität vom initialen Peak, die auf das Vorhandensein eines neuronalen Netzwerks hindeutet.
Ausgewählte Assays
Automatisierte Überwachung der Entwicklung und Analyse der Aktivität von aus iPSC gewonnenen 3D-Gehirn-Organoiden
Hier beschreiben wir eine Methode zur halbautomatisierten Kultivierung und Überwachung von Gehirnorganoiden sowie zur Untersuchung der funktionellen neuronalen Aktivität durch die Aufzeichnung der Ca2+-Oszillation. Das Hellfeld-Imaging mit einer auf künstlicher Intelligenz (KI) basierenden Segmentierung kann dabei helfen, die Qualität der sich entwickelnden Organoide zu überwachen, indem die Zunahme des Durchmessers und die Entwicklung der Form verfolgt wird. Die neuronale Aktivität von Gehirnorganoiden kann anhand der Calciumaktivität bestimmt werden. Die Calciumaktivität kann mithilfe des konfokalen Imaging nachgewiesen werden, um den Reifegrad der Neuronen zu bestimmen. Darüber hinaus kann durch konfokales Imaging mit unterschiedlichen Färbungen die zelluläre Organisation überwacht werden.
Neueste Ressourcen zur Organoidforschung
Die Komplexität von 3D-Assays ist nach wie vor ein Hindernis für die weit verbreitete Anwendung von Organoidmodellen für die Forschung und das Wirkstoffscreening. Neue fortschrittliche Imaging- und Analyse-Werkzeuge sowie die Automatisierung der Assays sind für die Verbesserung der Informationsqualität, des Durchsatzes und der Präzision komplexer biologischer Modelle entscheidend. Erfahren Sie, wie das High-Throughput-High-Content-Imaging und dessen Analyse zusammen mit KI-basierten Analysewerkzeugen die Genauigkeit Ihrer Organoidforschung verbessern können.