Die Rolle monoklonaler Antikörper gegen COVID-19
Entdecken Sie, warum mAbs eine Schlüsselrolle im Kampf gegen SARS-CoV-2 spielen und wie die Pandemie die Forschungs- und Entwicklungspipeline für mAbs geprägt hat.
In den letzten drei Jahren gewann die Entwicklung von Behandlungen für COVID-19 an Dynamik. Impfungen waren an der Spitze des Kampfes. Durch die Verabreichung von mRNA veranlassen Impfstoffe Ihre Zellen, eine harmlose Version des Spike-Proteins zu produzieren, wodurch Ihr Immunsystem angeregt wird, Antikörper zu produzieren, um die potenzielle Bedrohung zu bekämpfen. Die Frage ist, was passiert, wenn Sie bereits an COVID-19 erkrankt sind oder wenn Ihr Immunsystem beeinträchtigt ist, sodass Sie selbst nach der Impfung einem hohen Risiko für einen Krankenhausaufenthalt ausgesetzt sind. Hier treten monoklonale Antikörper ein, indem sie das Virus nach seinem Eindringen in den Körper angreifen und neutralisieren.
Podcast
Im neuesten Podcast mit Drug Target Review (Episode 6 - mAbs and SARS-CoV-2 with Dr. Carter Mitchell & Dr. Sharath Madasu, Kemp Proteins ) diskutierten Carter Mitchell, Chief Scientific Officer und Sharath Madasu, Manager of Protein Characterization of Kemp Proteins, die Rolle monoklonaler Antikörper (mAbs) gegen COVID-19 und wie die Pandemie ihre Entdeckung und Entwicklung geprägt hat.
Überprüfung des Wirkstoffziels · Episode 6 – mAbs und SARS-CoV-2 mit Dr. Carter Mitchell und Dr. Sharath Madasu, Kemp Proteins
Inhaltsverzeichnis
Warum sind mAk wirksam gegen SARS-CoV-2?
Monoklonale Antikörper (mAbs) wirken durch Virusneutralisierung auf Viren. Sie sind wirksam, da sie den Prozess unterbrechen, durch den das Virus entweder den Wirt erkennt oder das Virus internalisiert wird.
Wirkmechanismus monoklonaler Antikörper
Bei SARS-CoV-2 besteht das Ziel darin, die Bindung des Spike-Proteins mit den ACE2-Rezeptoren zu unterbrechen und so das Eindringen des Virus in die Wirtszellen zu verhindern. Das Spike-Protein vermittelt die Bindung durch seine Wiedererkennungs-Bindungsdomäne (RBD). Derzeit werden die meisten neutralisierenden monoklonalen Antikörper gegen die RBD angehoben.
Wie wirksam sind monoklonale Antikörper gegen COVID-19-Varianten?
Bei der Effektivität ist es aufgrund der wachsenden Anzahl an Varianten schwierig, eine einzige Antwort zu geben. Die Wirksamkeit variiert je nach Varianten. Obwohl die meisten für den Notfall zugelassenen Antikörper beispielsweise mit den Alpha- und Delta-Varianten arbeiten, weisen sie in der Omicron-Variante eine geringere Wirksamkeit auf.
Die Herausforderung bei Omicron besteht darin, dass es zumindest 36Mutationen auf dem Spike-Protein gibt, von denen sich einige auf dem RBD befinden. Diese Mutationen führen zu einer Differenzialglykosylierung, wodurch das Virus zuvor gebildete immunologische Reaktionen oder die Neutralisation monoklonaler Antikörper umgehen kann.
Glücklicherweise gelang es neueren Antikörpern wie Sotrovimab, ihre neutralisierende Aktivität in den jüngsten Varianten beizubehalten, sodass immer noch ein Hoffnungsschimmer herrscht. Dennoch kann die Wirksamkeit stark variieren. Einige Antikörper sind sehr wirksam gegen Alpha- und Beta-Varianten, jedoch nicht gegen die Gamma- oder Delta-Varianten. Im Gegensatz dazu sind die gegen Delta und Alpha wirksamen Antikörper gegen die Beta-, Gamma- und Omicron-Varianten viel weniger wirksam.
Die Auswirkung einer bestimmten Variantenmutation auf EC50 hängt davon ab, ob die Mutationen sich am bindenden Epitop befinden oder nicht.
Vorteile von mAk gegenüber anderen Covid-19-Therapien
Die Sicherheit in der erforderlichen Dosierung ist einer der Hauptvorteile monoklonaler Antikörper bei der COVID-19-Behandlung.
Laut Dr. Madasu hängt die Erfolgsquote der Rekonvaleszenten-Plasmatherapie stark vom Spender ab. Madasu erklärt weiter: „Mit der Rekonvaleszenten-Plasmatherapie, A) erwarten Sie, dass der Spender immer noch neutralisierende Antikörper produziert, und B) der Spender produziert ausreichend Mengen, um überhaupt wirksam zu sein. Mit monoklonalen Antikörpern wissen wir genau, wie viel eines neutralisierenden Antikörpers wir dem Patienten verabreichen, was ein großer Vorteil ist.“
Die Therapie mit konvaleszentem Plasma birgt zudem ein erhebliches Risiko für Plasmainkompatibilitäten zwischen den Patienten. Die Verwendung monoklonaler Antikörper als wirksame COVID-19-Behandlungsmethode reduziert diese Risiken erheblich.
Dr. Mitchell betont ein weiteres bemerkenswertes Merkmal der mAb-Therapie, die Fähigkeit, eine Untergruppe von pseudopolyklonalen Mischungen zu produzieren, die jede Art von Variante neutralisieren können, die in Zukunft auftreten könnte. Man könnte fragen: Wie können wir so sicher sein, dass diese Antikörper gegen zukünftige Varianten wirksam sind? Da jede Untergruppe über ein spezifisches Bindungsepitop verfügt, können die Mutationen schnell von einer oder einer Kombination von mAb-Untergruppen erkannt werden.
Dr. Mitchell gibt ein plausibles Beispiel für die potenziellen Vorteile polyklonaler Gemische. „Wenn in fünf Jahren eine neue Art von Variante herauskommt, könnten wir einen monoklonalen Antikörper gegen den Wildtyp PLUS verwenden, der 2023 als Kombinationstherapie herausgebracht wurde, um mehr Wirksamkeit gegen diese bestimmte Variante zu haben.“
Die Auswirkungen einer plötzlichen Pandemie
Die Entwicklung monoklonaler Antikörper hat sich unbestreitbar weiterentwickelt. Die Frage bleibt: Hätten die Fortschritte in der Produktion monoklonaler Antikörper noch stattgefunden, wenn es nicht für die COVID-19-Pandemie gewesen wäre?
Obwohl der Prozess für die Entwicklung monoklonaler Antikörper bereits etabliert war, erzeugte die Pandemie ein Gefühl der Dringlichkeit. Dr. Madasu ist zudem der Meinung, dass Menschen ein einfacheres/besseres Verständnis von Antikörpertherapien haben als Impfstoffe. In der frühen Phase der Pandemie war nicht klar, wie wirksam ein Impfstoff sein würde, daher zögerten bestimmte Personenabschnitte möglicherweise, den Impfstoff einzunehmen. Andererseits hatten die Menschen ein besseres Verständnis für Antikörper, sodass Antikörper-basierte Therapien breiter akzeptiert wurden.
Die Pandemie beschleunigte nicht nur die Verbesserung bestehender Strategien, sondern veranlasste auch die Entwicklung neuartiger Techniken. Technologien wie die High-Throughput-Oberflächenplasmon-Resonanz (SPR), die High-Throughput-Biolayer-Interferometrie (BLI) haben während der Pandemie Interesse gewonnen. Darüber hinaus haben sich die dynamische Lichtstreuung (DLS) und die FLD mit hohem Durchsatz erheblich verbessert. Eine der neueren Technologien war das auf künstlicher Intelligenz basierende Design monoklonaler De Novo-Antikörper, das die Geschwindigkeit und Komplexität von Antikörper-Discovery-Plattformen erhöhte.
Arbeitsablauf für monoklonale COVID-19-Antikörper
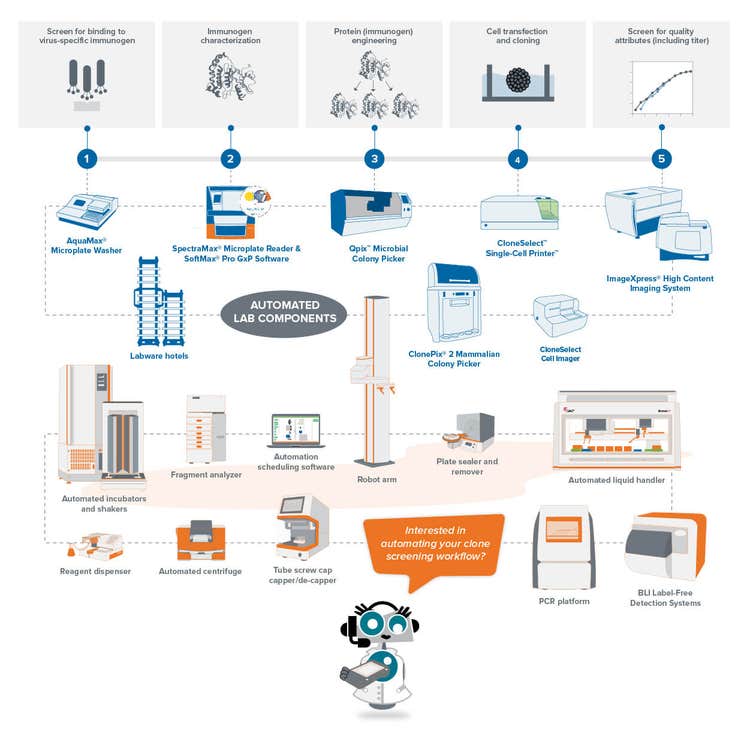
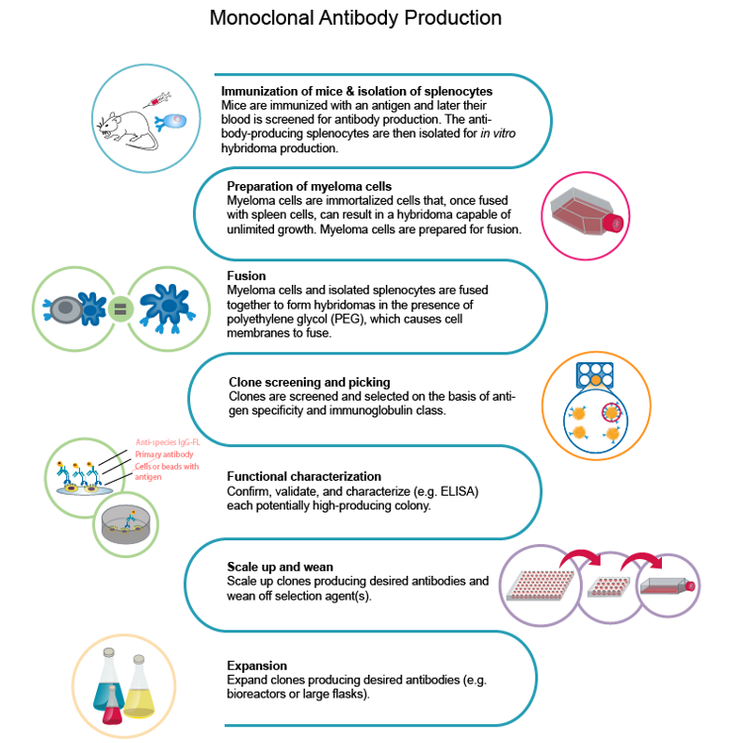
Der erste Schritt zur Erstellung des Arbeitsablaufs ist die Auswahl des Antigens, das zur Entwicklung monoklonaler Antikörper verwendet wird. In der Anfangsphase erfolgt die Immunisierung durch Verabreichung des Antigens an ein Tier, das eine Immunantwort entwickelt. Dann werden die Betazellen, die während der Immunantwort des Tieres erzeugt werden, isoliert, gefolgt von einer Fusion mit einer Myelomzelle, um das Hybridom zu erzeugen.
Laut Dr. Mitchell ist der Schlüssel zu einer erfolgreichen Anfangsphase die Optimierung des Antigens. „Im Falle von COVID-19 werden Antikörper hauptsächlich gegen das Spike-Protein, ein Trimmer, angehoben. Das Spike-Protein hat die Tendenz, Aggregate mit hohem Molekulargewicht zu bilden, was für die Immunisierungsstrategie möglicherweise nicht geeignet ist.“
Hinzu kommt, dass die Glykosylierungsmuster des Spike-Proteins von Zelltypen bis hin zu verschiedenen Spezies stark variieren.
Aus diesem Grund muss man bei der Antigenauswahl sehr vorsichtig sein. Selbst eine leichte Abweichung eines einzelnen Antigenglykans (z. B. in verschiedenen Varianten) kann die Erfolgsrate des Antikörpers erheblich beeinflussen.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonal-antibody-production
Herausforderungen und Engpässe
Immunisierung
Eine der größten Herausforderungen ist das Verständnis des viralen Genoms. Forschungsteams mussten üblicherweise Antigene synthetisieren und aufreinigen und deren Expression optimieren. Um den Erfolg der Expression und Aufreinigung zu bewerten, mussten sie sich jedoch auf die kollaborative Natur der Wissenschaftler verlassen, um die Informationen aus ihren eigenen Laboren zu veröffentlichen. Insgesamt kann die Immunisierung eines Tieres und die Erzeugung von Hybridomen allein bis zu acht Wochen dauern.
Einzelzellen-Isolierung
Nach der Identifizierung des qualitativ besten Antigens für die Immunisierungsstrategie besteht die nächste Herausforderung darin, eine ausreichende Anzahl an B-Zellen für die Einzelzellisolation von Hybridomen zu erhalten.
Die traditionelle Methode zum Wachstum dieser Hybridome ist ein halbfestes Medium, das es der Einzelzelle ermöglicht, eine Kolonie zu bilden. Dies war früher ein langsamer Prozess, hat aber seitdem mit Roboterinstrumenten an Dynamik gewonnen, die das Drucken einzelner Zellen in jedes Well einer Mikrowell-Platte ermöglichen und so sowohl den Durchsatz als auch die Effizienz verbessern.
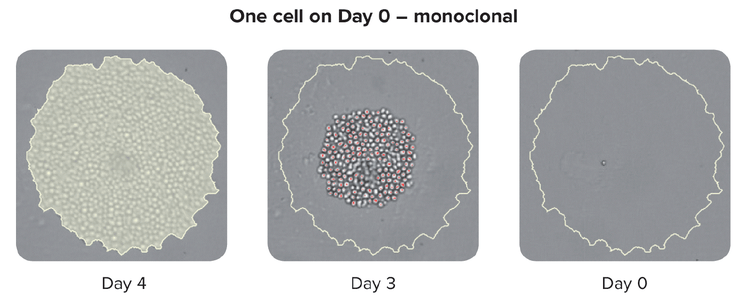
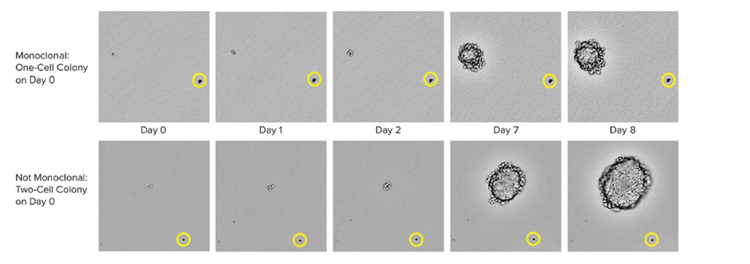
Es ist wichtig anzumerken, dass fortschrittliche Einzelzell-Isolierungswerkzeuge auch eine erhöhte Effizienz des klonalen Auswuchses und die Verifizierung der Monoklonalität ermöglichen, dass die Kolonie aus einer einzigen Zelle erzeugt wurde.
Monoklonalität im großen Maßstab
Für die Monoklonalität im großen Maßstab muss die rekombinante Form eines Einzelzell-isolierten Hybridoms erzeugt werden, da die Einzelzellisolation für die klinisch relevante mAb-Generierung unzureichend ist. Die Zulassung für klinische Studien erfordert die rekombinante Erzeugung des mAb und seiner Formulierung zu einem humanen Antikörper, der eine angemessene immunologische Reaktion ermöglicht.
Um stabile Zelllinien zur Erzeugung von mAbs in ausreichenden Konzentrationen zu bilden, müssen Sie das Gen sequenzieren und in ein menschliches Konstrukt manipulieren. CHO-Zelllinien werden für die rekombinante Erzeugung mit dem Ziel der Produktion von 8–20 g/l mAb verwendet.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
Zeit- und finanzielle Einschränkungen
Zeit und Kosten sind Schlüsselfaktoren, die bei mAb-Arbeitsabläufen zu berücksichtigen sind
Obwohl die Erzeugung stabiler Klone innerhalb von 12 Tagen nach der ersten Fütterung erreicht werden kann, kann die vollständige monoklonale Sicherstellung mit herkömmlichen Klonierungsmethoden bis zu sechs Monate dauern. Noch wichtiger ist, dass die Erzeugung einer vollständig realisierten mAb-Struktur teuer sein kann. Die Lösung wäre die Bildung von einkettigen variablen Fragment-Antikörpern oder VHH-Nanokörpern. Dies sind die kleinstmöglichen Antikörperfragmente, die eine spezifische Bindungsaffinität für ein Antigen aufweisen. Dr. Mitchell fasst zusammen, warum dieser Ansatz so leistungsstark ist:
„Durch die Umwandlung von mAk in kleinere Nanokörper können wir sie in E. coli auf wesentlich kostengünstigere Weise produzieren. Das senkt die Kosten und macht es zu einem weit gefassten Therapeutikum im Gegensatz zu den nur in entwickelten Ländern verfügbaren.“
Laut Dr. Madasu erleichtern ihre stabilen Strukturen die Verteilung in weniger entwickelte Länder. „Wir müssen an andere weniger entwickelte Länder ohne Zugang zu Lagereinrichtungen denken. Einige dieser Nanokörper sind ziemlich stabil und könnten unter weniger strengen Bedingungen gelagert werden.“
Die Konversion von Antikörpern zu Nanokörpern ist ein entscheidender Schritt, um mAbs-basierte Therapien weltweit zu geringeren Kosten zu verteilen. Insbesondere in weniger entwickelten Ländern mit unzureichenden Lagereinrichtungen würden Nanokörper auch bei extremen Temperaturen stabil bleiben.
Sicherstellung der Monoklonalität und Beschleunigung der COVID-19-mAb-Produktion durch Automatisierung
Sicherstellung der Monoklonalität
Zu den Methoden zur Sicherstellung der Monoklonalität im großen Maßstab gehören automatisierte Technologien wie das Drucken einzelner Zellen oder das Picken von Kolonien. Beim Picken einer isolierten Kolonie aus dem HAT-Medium nimmt das Gerät Bilder über einen Zeitraffer von Tag Null nach dem Picken der Kolonie auf. Der Augenzeugennachweis stellt einen Nachweis der Monoklonalität dar. Um sicherzustellen, dass leistungsstarke Klone Labore zellbasierte oder immunbasierte Assays in Kombination mit bildbasierten Methoden verwenden können. Diese kombinierte Strategie stellt sicher, dass Sie Monoklonalität haben und dass Ihre Klone eine einzige Vielfalt des Antikörpers sezernieren. Als letzter Schritt des Prozesses ist es auch hilfreich, Epitopbindungs-Assays durchzuführen, um festzustellen, ob die Epitopbindung einheitlich ist.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
Die Rolle der Robotik in der Durchlaufzeit
Die letzte Möglichkeit, die Entwicklungszeit zu verkürzen, ist die Implementierung von High-Throughput-Robotik zur Untersuchung der Klone. In automatisierten mAb-Arbeitsabläufen für COVID-19 hat die automatisierte Aufreinigung immens geholfen, das Verhalten der Klone und die Möglichkeit zu verstehen, dass der monoklonale Antikörper Aggregate mit hohem Molekulargewicht bildet.
Diese Methode bietet einen besseren Überblick über den Protein- oder Epitopraum, indem sie die Robotik auf eine Weise mit hohem Durchsatz nutzt, um immer neue Therapeutika auf den Markt zu bringen. Eine hohe Anzahl an Klonen maximiert Ihre Chancen, mAbs zu erhalten, die alle gewünschten Eigenschaften abdecken, anstatt einen einzigen mAb mit teilweiser Abdeckung des Antigens zu haben.
Mit Arbeitsabläufen mit hohem Durchsatz kann man den Fokus auf eine Untergruppe von Monoklonen mit der höchsten Ausbeute beschränken. Sie können dann mit den am höchsten eingestuften Untergruppen fortfahren, um weitere Bewertungen in Tierstudien und toxikologischen Tests durchzuführen. Sie würden auch Zeit sparen, indem Sie Untergruppen eliminieren, die nicht für Aufreinigungen im großen Maßstab geeignet sind, wodurch ein Geldabfluss während der COVID-19-Forschung des Labors verhindert wird.
Automatisierung von mAb-Laborprozessen in der Zukunft
Viele COVID-19-Forschungslabore haben bereits automatisierte Prozesse implementiert, da sie in der Lage sind, Daten für Tausende von Klonen pro Woche zu erzeugen. Das Verständnis der therapeutischen Mechanismen von mAb ist bei automatisierter Synthese, Expression, Aufreinigung und biophysikalischer Charakterisierung viel wahrscheinlicher.
Noch wichtiger ist, dass die Automatisierung den Weg für unvoreingenommene Analysemethoden und Selektionskriterien ebnet. Eine objektive Analyse ist für die Diversifizierung der Bibliothek von Antikörpern für eine breite Palette an Varianten und Mutationen erforderlich, um eine Skalierung von Antikörpern zu vermeiden, die nur einen engen Satz von Varianten behandeln.
Die Zukunft der SARS-CoV-2-Forschung und die Rolle monoklonaler Antikörper
Die mAb-basierten Therapeutika befinden sich seit der ersten mAb-Zulassung der Entwicklung von muromonab-CD3 (Orthoclone OKT3) durch 1986 die FDA auf dem US-Markt, um die akute Abstoßung bei Patienten mit Organtransplantaten zu reduzieren. (1) Die aktuelle COVID-19-Forschung erhöht auch die Bedeutung monoklonaler Antikörper in der Diagnostik. Tatsächlich spielten monoklonale Antikörper eine entscheidende Rolle beim Nachweis von SARS-CoV-2-Varianten.
Neben der Diagnostik helfen aktuelle mAk Forschern, notwendige Modifikationen zu bestimmen und sogar die Entwicklung von Impfstoffkandidaten zu unterstützen. Bei der Untersuchung, ob ein Referenz-mAb eine Virusvariante neutralisieren kann, können Forscher entscheiden, ob sie effizientere neuartige Therapeutika entwickeln möchten.
Während mRNA-basierte Impfstoffe im Mittelpunkt des Kampfes gegen COVID-19 standen, standen monoklonale Antikörper hinter den Kulissen verschiedener Anwendungen, von proteinbasierten Impfstoffen bis hin zu antikörperbasierten Therapeutika.
Dr. Madasu und Dr. Mitchell sind der Meinung, dass in Zukunft monoklonale Antikörper insbesondere auf die ungeimpfte Population angewendet werden könnten, darunter Säuglinge, Patienten mit Begleiterkrankungen (die nicht gut auf Impfstoffe ansprechen) und Menschen, die zögern, sich impfen zu lassen. Wie bereits erwähnt, ist es entscheidend, kosteneffektive mAb-basierte Therapeutika herzustellen und sie so weit wie möglich verfügbar zu machen, indem die Effizienz im Forschungs- und Produktionsprozess gesteigert wird.
Entdeckung monoklonaler Antikörper gegen COVID-19 mit den Laborautomatisierungslösungen von Molecular Devices
Das Klon-Screening ist einer der Engpässe bei der Entdeckung monoklonaler Antikörper, da Sie Tausende von Zellen in Bezug auf das Zielantigen testen und analysieren müssen. Automatisierte Arbeitsabläufe für das Screening von Klonen können dazu beitragen, diese Belastung zu überwinden, indem sie die praxisnahe Zeit reduzieren und die aus mehreren Prozessen extrahierten Daten vereinheitlichen und standardisieren.
Molecular Devices hat integrierte Workflow-Lösungen für die wesentlichen Schritte entwickelt. Automatisierte Arbeitsabläufe zur Entwicklung von Zelllinien zielen darauf ab, monoklonale Zelllinien zu produzieren, die konsistente und ausreichende Mengen des therapeutischen Zielproteins produzieren. Der automatisierte Arbeitsablauf des molekularen Klonens zielt darauf ab, Fehler und Kontaminationen während der Isolierung von DNA-Sequenzen zu minimieren, die als Vektoren in die Spezies Ihrer Wahl propagiert werden.
Diese Arbeitsabläufe maximieren die Ausbeute an Zielproteinen und bieten gleichzeitig die Möglichkeit, andere Instrumente für eine voll automatisierte Arbeitszelle in die Robotertechnik zu integrieren. Insgesamt sind solche Arbeitsabläufe kosteneffektiv, zeitsparend und mit sich ändernden Forschungszielen leicht zu modifizieren.
Auf unserer Seite Laborautomatisierung für das High-Throughput-Screening von Klonen können Sie mehr über Arbeitsabläufe in der Zelllinienentwicklung erfahren. Vergessen Sie nicht, unsere Anwendungsseite für monoklonale Antikörper zu besuchen, um die Herstellungsmethoden für mAb und die Feinheiten jedes einzelnen Schritts zu sehen.
- Wang, S. S., Yan, Y. S., & Ho, K. ( 2021). Von der US-amerikanischen FDA zugelassene therapeutische Antikörper mit hochkonzentrierter Formulierung: Zusammenfassungen und Perspektiven. Antikörpertherapeutika , 4(4), 262–272. https://doi.org/10.1093/abt/tbab027