
[Podcast] Herausforderungen der traditionellen Zelllinienentwicklung und aufkommende neue Technologien zur Kontrolle der Monoklonalität
Fortschritte in der Gentechnik und der synthetischen Biologie haben in den letzten Jahrzehnten zahlreiche Durchbrüche ermöglicht. Die Bedeutung der Zelllinien-Entwicklung muss hierbei lobend erwähnt … Ohne diese Impfstoffe wären viele lebensrettende Impfstoffe für Infektionskrankheiten, Antikörper-Arzneimittel und rekombinante Proteinprodukte, einschließlich Insulin, nicht weit verbreitet. Der schwierigste Schritt bei der Entwicklung konformer Zelllinien ist die Sicherstellung der Monoklonalität, vor allem, wenn sie manuell durchgeführt werden. Die Monoklonalität therapeutischer Zelllinien muss aus regulatorischen Gründen erreicht und dokumentiert werden.
In unserem Podcast „Cell line development with Dr. Natasa Skoko, ICGEB & Dr. Hugh Graham, MacroGenics“ diskutieren wir traditionelle Arbeitsabläufe für die Entwicklung von Zelllinien und die neuen Technologien zur Verifizierung der Monoklonalität.
Hier haben wir die wichtigsten Diskussionspunkte von Fachrednern zusammengefasst: Dr. Natasa Skoko von der Group Leader of the Biotechnology Development Unit am International Centre for Genetic Engineering and Biotechnology (ICGEB) und Dr. Hugh Graham, Director of Cell Culture Sciences bei MacroGenics.
Zelllinienentwicklung
Sicherstellung der Monoklonalität
Neue Technologien und regulatorische Auswirkungen
Bedeutung stabiler Zelllinien
In der einfachsten Form definiert der Begriff Zelllinie eine Zellpopulation, die für einen bestimmten Zeitraum in einer Kultur erhalten bleiben kann und einen bestimmten Phänotyp, eine bestimmte Funktion und Stabilität beibehält.
Dr. Skoko fasst die historische Bedeutung der stabilen Zelllinie zusammen. „Die Verwendung der Zelllinie hat die Revolution bewirkt, nicht nur in der wissenschaftlichen Forschung, und dazu beigetragen, viele grundlegende biologische Prozesse zu verstehen“, seine Anwendungen reichen von der Antikörper- und therapeutischen Proteinproduktion bis hin zum Wirkstoffscreening.
Die Zelllinienentwicklung umfasst technisch veränderte Säugetierzellen, die robust, kostengünstig und leicht zu wachsen sind. Eine Zelllinie, die alle Kriterien erfüllt, ist die Chinese Hamster Ovary (CHO)-Zelle, die erstmals im Jahr entwickelt wurde1987. Heute werden 70% der auf dem Markt erhältlichen Biotherapeutika aus CHO-Zelllinien hergestellt. Sie sind besonders effizient in der Massenproduktion von Biotherapeutika, da sie sich an verschiedene Wachstumsmedien und Wachstumsbedingungen (z. B. Suspension, gebundenes Wachstum, Fed-Batch, Perfusion) anpassen lassen und Proteine falten und glykosylatieren können, um posttranslationale Modifikationen in humanen Proteinen nachzuahmen.
Herausforderungen eines herkömmlichen Arbeitsablaufs zur Zelllinienentwicklung
Die Produktion hoher Biotherapeutika-Mengen beruht auf der Erzeugung stabiler Zelllinien.
Der erste Schritt ist die Transfektion einer geeigneten Wirtszelllinie mit dem zu untersuchenden Gen, was zu einer zufälligen Integration der DNA in das Wirtsgenom führt. Sobald die veränderte Zelllinie zu wachsen beginnt, üblicherweise unter Selektionsdruck, ist eine Einzelzellisolation erforderlich, um Klone für das Screening zu erzeugen.
In herkömmlichen Arbeitsabläufen werden die Zellen durch die limitierende Verdünnung auf eine 96-Well-Platte plattiert. Bei dieser Methode wird die Zellsuspension so verdünnt, dass die Wahrscheinlichkeit, dass sie nur eine Zelle hat, sehr hoch ist, wenn Sie eine bestimmte Menge in ein Well ausplattieren. Einige Wells können sogar leer sein und einige können mehrere Zellen enthalten. Daher ist die Wahrscheinlichkeit groß, dass eine Zelllinie aus einem dieser Wells aus einer einzigen Zelle entsteht.
Das ist großartig, aber wie lange dauert es? Unter der Annahme, dass die Anzahl der Zellen sich alle 24 Stunden verdoppelt, sind zehn Verdopplungen erforderlich, um tausend Zellen zu erreichen, was 10 Tage dauern würde. Um genügend Zellen zu erhalten, mit denen man arbeiten kann, würde 2es bis3 Wochen dauern. Darüber hinaus verlangen die Vorschriften für die Monoklonalität, dass Sie die limitierende Verdünnung wiederholen, um eine weitere Sicherung des klonalen Ursprungs für Ihre Zelllinie zu erhalten. Sie müssten also Monate damit verbringen, Ergebnisse aus dieser Methode mit niedrigem Durchsatz zu erhalten. Dr. Graham fügt hinzu: „Die Stabilität der Zelllinie wird beaufschlagt. Wenn Sie die gewünschten Zahlen erreichen und eine hohe Sicherstellung der Monoklonalität haben, besteht die Möglichkeit, dass sie in ihren Eigenschaften verdriftet sind, einige Kopien des Gens von Interesse verloren haben oder auf eine Weise angepasst wurden, die Sie nicht erwartet hatten.“
Zusammenfassend lässt sich sagen, dass eine limitierende Verdünnung die Geschwindigkeit, Compliance und Zelllinienqualität nicht erreichen kann, da es schwierig ist, die Monoklonalität zu dokumentieren und die Qualität Ihrer Zellen zu erhalten. Sowohl Dr. Skoko als auch Dr. Graham sind sich einig, dass die Automatisierung der Weg ist, das Wachstum monoklonaler Zelllinien mit hohem Durchsatz und deren Dokumentation zu erleichtern.
Grundlagen der monoklonalen Zelllinie
Gehen wir nun einen Schritt zurück, um die Monoklonalität zu definieren. Eine monoklonale Zelllinie stammt aus einer einzelnen Zelle oder aus einem einzigen Vorläufer.
Warum ist das so ein großes Problem? Wenn Zellen wachsen und sich verdoppeln, unterliegen sie genetischen Drifts, Mutationen oder dem Verlust eines Plasmids. Daher ist es fast unmöglich sicherzustellen, dass die Qualität der von ihnen exprimierten therapeutischen Proteine einheitlich ist, indem einfach deren neuester Phänotyp untersucht wird.
Um dies zu kompensieren, müssen Sie beginnen, Ihre Zellen an Tag Null zu dokumentieren, um nachzuweisen, dass sie tatsächlich aus einer einzigen Zelle stammen.

Das CHO-s-Zellwachstum wurde verwendet, um Bilder von den -Well6-Platten zu mehreren Zeitpunkten aufzunehmen. An Tag ist in der oberen Reihe deutlich zu sehen0, dass eine Zelle vorhanden ist, während in der unteren Reihe zwei Zellen zu beobachten sind. Der gelbe Kreis zeigt die Position eines Beads an, der als Ortsreferenz dient, um zu bestätigen, dass die gleiche Kolonie im Laufe der Zeit aufgenommen wird.
Typische Monoklonalitätsnachweise, nach denen Regulatoren suchen, sind bildbasiert, d. h. das Bild einer einzelnen Zelle muss aufgezeichnet werden.
Die effektivste Ausrüstung zur Entwicklung monoklonaler Zelllinien ist ein Einzelzelldrucker, der Einzelzellabscheidungen durchführt. Weitere Methoden umfassen die Fluoreszenz-aktivierte Zellsortierung (FACS) und Arbeitsabläufe, die jeden Schritt von der Inkubation bis zur Pipettierung automatisieren.
Bedeutung der Verifizierung der frühen Monoklonalität
Die Monoklonalitätssicherung in einem frühen Stadium hat mehrere Auswirkungen auf Life Science-Anwendungen. Dr. Graham hebt die Bedeutung der Monoklonalität für den Arzneimittelentwicklungszyklus hervor: „Vor zehn oder mehr Jahren wurden Zelllinien und Moleküle entwickelt, die in Richtung Kommerzialisierung gehen. Die Klonierungsprozesse von vor zehn Jahren verfügen möglicherweise nicht über die erforderliche Dokumentation, um einen klonalen Ursprung sicherzustellen. Wenn man eine solche Zelllinie zu einem Regulator bringt, werden Sie möglicherweise gebeten zu zeigen, dass sie ursprünglich von einer klonalen Zelllinie stammt. Wenn Sie diesen Nachweis nicht haben, ist es eine Menge Arbeit, ihn später im Projekt nachzuweisen.“
Dr. Skoko fügt hinzu: „Es geht darum, Risiken zu minimieren und einen konsistenten Produktionsprozess und eine gleichbleibende Produktqualität zu gewährleisten. Aus diesem Grund ist es von grundlegender Bedeutung, die Monoklonalität in der frühen Phase sicherzustellen. Der Beginn mit einer Zellbank mit einer hohen Sicherstellung der Monoklonalität führt zu weniger Arbeit später. Darüber hinaus vermeiden Sie schwerwiegende Unterbrechungen in der Herstellung und verringern die Unsicherheit bei Änderungen am Herstellungsprozess.“
Neue monoklonale Technologien zur Verifizierung von Einzelzelllinien
Neue Techniken für das Imaging und die Kultivierung monoklonaler Zelllinien wachsen. Hier sind einige Beispiele:
- Die halbfeste Zellsuspension, bei der eine einzelne Zelle in einer halbfesten Suspension wächst, kann mit zunehmendem Wachstum abgebildet werden.
- Ein Klonring, der eine einzelne Zelle umgibt, um sie zu isolieren und vor Kontamination zu schützen
- FACS: Die Sortierung von Zellen auf Grundlage von Fluoreszenzeigenschaften
- Mikrofluidische, tropfenbasierte Einzelzellendrucker mit der Möglichkeit, neu beschichtete Wells mit Einzelzellen abzubilden
Diese kombinierten Methoden verbessern die Glaubwürdigkeit von Monoklonalitätsbeweisen.
Natürlich besteht ein großes Potenzial, die aktuellen Techniken zu verbessern und überlegene zu erfinden. In erster Linie müssen visuelle Nachweise, d. h. Einzelzell-Imaging, häufiger verwendet werden, da sie die kosten- und zeitbezogenen Herausforderungen der limitierenden Verdünnung und der Flusszytometrie-Sortierung überwinden.
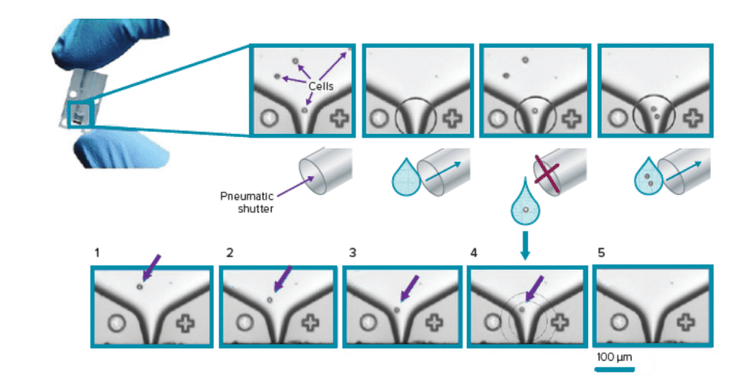
Die CloneSelect Single-Cell Printer Series ist ein voll automatisiertes System, das die firmeneigene, auf Mikrofluidik basierende Technologie und Bildanalyse in Echtzeit nutzt, um einzelne Zellen zu sortieren und in Standard-Mikroplatten abzuscheiden – und gleichzeitig die Monoklonalität durch Bilddokumentation gewährleistet.
Weitere Verbesserungen sind in der gesamten Produktionslinie möglich. Die Verbesserung der Analysemethoden in der therapeutischen Proteinproduktion kann uns beispielsweise dabei helfen, den gesamten Herstellungsprozess zu überwachen. Dadurch werden genetische Schwankungen unter Kontrolle gebracht und die Einheitlichkeit des hergestellten Proteins sichergestellt.
Ein weiteres Problem bei der Entwicklung monoklonaler Zelllinien ist die Geschwindigkeit. Dr. Graham betont: „Das Warten auf eine klonale Zelllinie, um Ihr Protein in eine Klinik zu bringen, ist eine Zeitbarriere. Heute bewegen sich die Menschen in Richtung der ersten Proteinchargen aus Pools früher Klone für das erste klinische Material der Guten Herstellungspraxis (Good Manufacturing Practice, GMP). Dann erzeugt man die klonale Zelllinie für klinische Studien im späteren Stadium und die GMP-Produktion. Die Eliminierung des Bedarfs an Nachweisen klonaler Genese in frühen klinischen Studien ist ein interessanter Ansatz, um die Entwicklung von Biotherapeutika zu beschleunigen. Dieser Ansatz kann jedoch zusätzliche Arbeit erfordern, um die behördliche Genehmigung zu erhalten.“
Die Rolle der Regulierung und ihre Auswirkungen auf den Zelllinienentwicklungsprozess
Wie Sie sehen können, wirken sich Vorschriften unbestreitbar auf die Entwicklung monoklonaler Zelllinien aus. Eine Folge strenger Vorschriften ist, dass der Hersteller vor der Beantragung der Genehmigung einen umfassenden Bericht über die monoklonale Zelllinie vorlegen muss. Unzureichende Nachweise oder fehlende Dokumente können zu Verzögerungen bei der Regulierung oder zusätzlichen Verpflichtungen nach der Zulassung führen. Da die behördliche Zulassung eine ausgezeichnete wissenschaftliche Unterstützung erfordert, ist es am besten, von den frühen Stadien an so viele Nachweise wie möglich zu erbringen, insbesondere für den klonalen Ursprung.
Was hält die Zukunft für Arbeitsabläufe in monoklonalen Zelllinien bereit?
Es gibt ungelöste Herausforderungen bei Arbeitsabläufen in monoklonalen Zelllinien, einschließlich finanzieller Bedenken, der Erzielung von High-Throughput-Ergebnissen und der Sicherstellung monoklonaler Herkunft.
Im Vergleich zu herkömmlichen Methoden verfügen die Entwickler monoklonaler Zelllinien von heute über viel bessere Werkzeuge, um die Einhaltung gesetzlicher Vorschriften und die Qualität der Zelllinien sicherzustellen.
Ein interessanter Aspekt ist ein verbessertes Datenmanagement, das notwendig ist, um große Datensätze zu organisieren, die aus Studien zur Zelllinienentwicklung generiert wurden. Die Kombination von Datenmanagement und maschinellem Lernen kann zu einer Plattform führen, die die Qualität eines Biotherapeutikums ausschließlich auf Grundlage klonaler Herkunft vorhersagt.
Die Rolle der Automatisierung wird auch bei Geschwindigkeit und Konsistenz immer wichtiger. Genauer gesagt kann die Automatisierung die Entwicklung von Klonen und das Screening von Kolonien beschleunigen. Dr. Skoko erklärt die Auswirkungen der Automatisierung: „Wir sprechen über das Screening von 10.000 Klonen in ein paar Wochen. Ein herkömmlicher Arbeitsablauf dauert zwischen 30 Wochen und zwei Jahren. Die automatisierte Technologie kann uns dabei helfen, genaue Klone zu haben, Fehler im Zusammenhang mit der herkömmlichen limitierenden Verdünnung zu eliminieren und die Arbeit mit einer heterogenen Population verschiedener Sekretoren zu überwinden. Sie können die Stabilität Ihrer Klone von Anfang an beurteilen.“
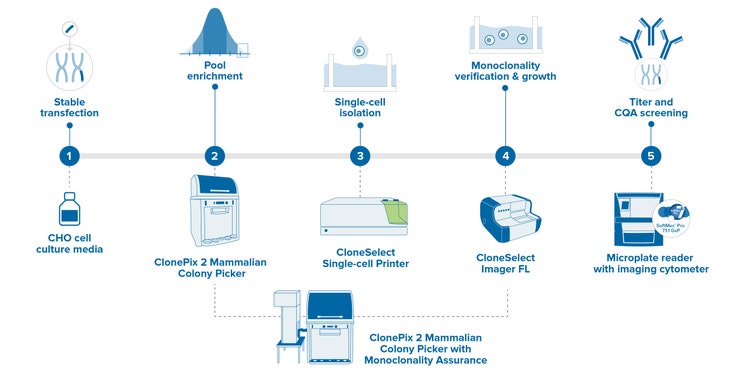
Automatisierter Arbeitsablauf zur Entwicklung von Zelllinien mit Sicherstellung der Monoklonalität
Durch die Integration von Automatisierungstechnologien können Sie Hunderttausende von Klonen screenen, um den goldenen Klon zu finden, der die höchste Ausbeute für das Protein Ihres Interesses erzielen kann. Noch wichtiger ist, dass es Ihnen hilft, jeden Schritt des Entwicklungsprozesses vom Tag Null an vollständig zu dokumentieren. Letztendlich können Sie Geld und Zeit sparen, indem Sie zukünftige Konflikte vermeiden, die durch mangelnde Monoklonalitätssicherung oder inkonsistente Produktqualität verursacht werden.
Beschleunigen Sie Ihre Zeitachsen für die Entwicklung von Zelllinien, indem Sie mehrere Schritte in einen einzigen Schritt integrieren. Der verbesserte ClonePix 2 Säugetierkolonie-Picker mit Monoklonalitätssicherung kann Klone, die sowohl produzierend als auch monoklonal sind, automatisch screenen und picken – alles in einem System. Screenen Sie mehr Klone in weniger Zeit – mit Verifizierung monoklonaler Zellen an Tag Null. Dann screenen Sie auf die am stärksten produzierenden Klone und picken diese innerhalb von weniger als zwei Wochen. Die schnelle Z-Stapel-Erfassungsfunktion ermöglicht an Tag die Erkennung einzelner Zellen im gesamten Volumen des Mediums – nicht nur in einer einzelnen Bildebene

Molecular Devices verfügt über ein robustes Portfolio zur Automatisierung Ihres Arbeitsablaufs in der Zelllinienentwicklung und über Technologien zur Sicherstellung der Monoklonalität, einschließlich Klon-Picking, Einzelzellisolation und Imaging sowie Mikroplatten-Reader. Unsere bewährten GxP-Lösungen tragen dazu bei, die Datenintegrität und Konformität von GMP/GLP-Laboren sicherzustellen.
Erfahren Sie mehr über Anwendungen zur Entwicklung von Zelllinien und Monoklonalität oder sprechen Sie mit einem Automatisierungsspezialisten, wenn Sie eine automatisierte Lösung für Ihr Labor erforschen möchten.