
Die Evolution der Rolle von CHO-Zellen bei der Entwicklung von Zelllinien
Seit der ersten Zulassung von rekombinantem Insulin und humanem Wachstumshormon in den frühen 1980er Jahren wurde eine Vielzahl von rekombinanten Proteintherapeutika von den Zulassungsbehörden zugelassen, insbesondere von der FDA in den USA und der EMA in Europa. Angesichts dieses deutlichen Anstiegs der erfolgreichen Einführung biologischer Therapeutika besteht im Bereich der Wirkstoffforschung ein entscheidender Bedarf an der Unterstützung effizienterer Herstellungsprozesse, die hochproduktive Zelllinien erfordern.
Die Chinese Hamster Ovary (CHO)-Zellen sind eine epithelialartige Zelllinie, die für eine Transfektion sehr ansprechbar ist und sich als Goldstandard für die Herstellung zugelassener therapeutischer Proteine herausgestellt hat.
Warum werden CHO-Zellen verwendet?
Mehrere Schlüsseleigenschaften von CHO-Zellen haben ihre Etablierung als bevorzugte Wirtszelllinie für die Zulassung rekombinanter therapeutischer Produkte durch Behörden vorangetrieben:
1
Anpassbar an das Wachstum in Suspensionskulturen, ideal für die Produktion in großen Produktionsmaßstäben in Bioreaktoren
2
Anpassbar an das Wachstum in serumfreien und chemisch definierten (tierfreien) Medienergänzungsmitteln, wodurch die Reproduzierbarkeit zwischen verschiedenen Zellkulturchargen gewährleistet wird
3
Posttranslationale Modifikationen (z. B. Glykosylierungen) rekombinanter Proteine ermöglichen, die beim Menschen kompatibel und bioaktiv sind
4
Für CHO-Zellen wurden mehrere chemische Selektions- und Genamplifikationssysteme entwickelt, die für eine höhere Ausbeute an rekombinanten Proteinen pro Zelle optimiert wurden.
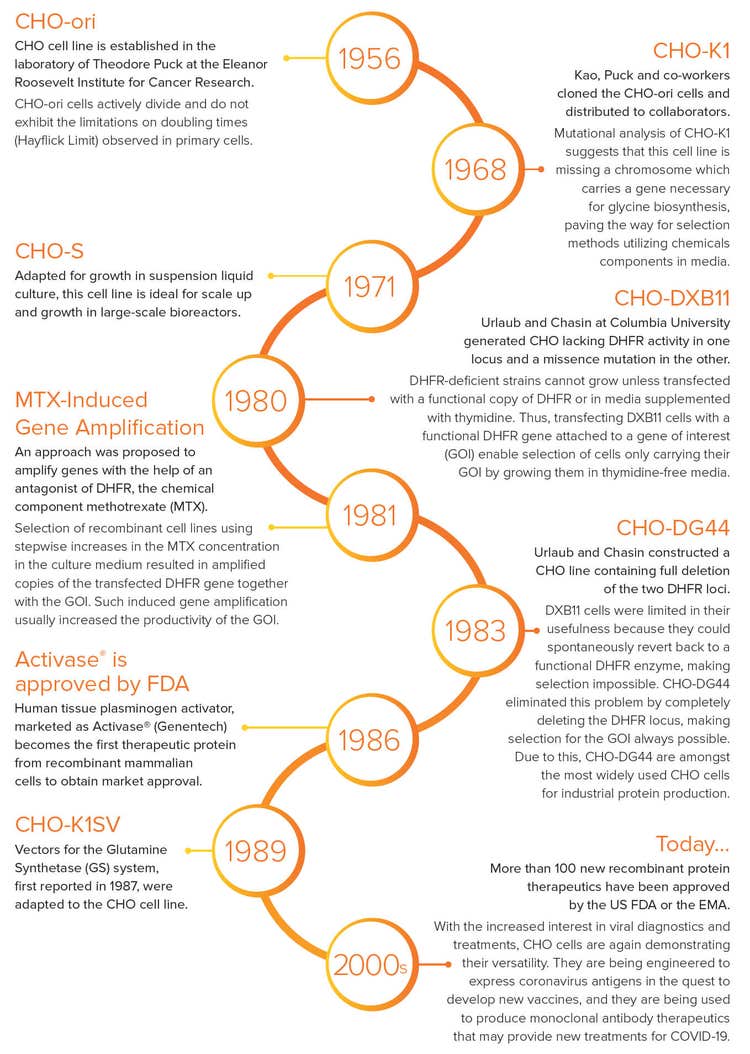
Geschichte der CHO-Zellen
Laden Sie die Infografik herunter
1956 - CHO-ori-Zellen
Die CHO-Zelllinie wurde im Labor von Theodore Puck am Eleanor Roosevelt Institute for Cancer Research etabliert. CHO-ori-Zellen teilen sich aktiv und weisen keine Einschränkungen der Verdopplungszeiten (Hayflick-Grenze) auf, die in Primärzellen beobachtet werden.
1968 - CHO-K1-Zellen
Kao, Puck und Kollegen klonten die CHO-ori-Zellen und verteilten sie an die Mitarbeiter. Die Mutationsanalyse von CHO-K1 deutet darauf hin, dass dieser Zelllinie ein Chromosom fehlt, das ein für die Glycin-Biosynthese erforderliches Gen trägt, was den Weg für Selektionsmethoden ebnet, die chemische CHO-S-Komponenten in Medien verwenden.
1971 - CHO-S-Zellen
Diese Zelllinie wurde für das Wachstum in Suspensionsflüssigkeitskulturen angepasst und eignet sich ideal für das Scale-Up und das Wachstum in großen Bioreaktoren.
1980 - CHO-DXB11-Zellen
Urlaub und Chasin an der Columbia University generierten ein CHO ohne DHFR-Aktivität an einem Ort und eine Missence-Mutation am anderen Ort. DHFR-defiziente Stämme können nicht wachsen, es sei denn, sie wurden mit einer funktionellen Kopie von DHFR transfiziert oder in Medien, die mit Thymidin ergänzt wurden, verwendet. Somit ermöglicht die Transfektion von DXB11-Zellen mit einem funktionellen DHFR-Gen, das an ein Gen von Interesse (GOI) gebunden ist, die Selektion von Zellen, die nur ihren GOI tragen, indem sie in Thymidin-freien Medien züchtet werden.
1981 - MTX-induzierte Genamplifikation
Ein Ansatz wurde vorgeschlagen, um Gene mithilfe eines DHFR-Antagonisten, der chemischen Komponente Methotrexat (MTX), zu verstärken. Die Selektion rekombinanter Zelllinien durch schrittweise Erhöhung der Konzentration von MTX im Kulturmedium führte zu amplifizierten Kopien des transfizierten DHFR-Gens zusammen mit dem GOI. Eine solche induzierte Genamplifikation erhöhte in der Regel die Produktivität des GOI.
1983 - CHO-DG44-Zellen
Urlaub und Chasin konstruierten eine CHO-Linie mit vollständiger Deletion der beiden DHFR-Loci. DXB11-Zellen waren in ihrer Nützlichkeit eingeschränkt, da sie spontan zu einem funktionellen DHFR-Enzym zurückkehren konnten, was eine Selektion unmöglich machte. CHO-DG44 beseitigte dieses Problem, indem es den DHFR-Locus vollständig löschte und die Auswahl für den GOI immer möglich machte. Aus diesem Grund gehört CHO-DG44 zu den am häufigsten verwendeten CHO-Zellen für die industrielle Proteinproduktion.
1986 - Activase® ist von der FDA zugelassen
Der als Activase® (Genentech) vermarktete Plasminogenaktivator für Humangewebe wird das erste therapeutische Protein rekombinanter Säugetierzellen, das die Marktzulassung erhält.
1989 - CHO-K1SV-Zellen
Vektoren für das Glutamin-Synthetase(GS)-System, das erstmals im Jahr berichtet wurde1987, wurden an die CHO-Zelllinie angepasst.
2000 - Heute ...
Mehr als 100 neue rekombinante Proteintherapeutika wurden von der US-amerikanischen FDA oder der EMA zugelassen.
Mit dem zunehmenden Interesse an Virusdiagnostik und -behandlungen zeigen CHO-Zellen erneut ihre Vielseitigkeit. Sie werden so konstruiert, dass sie Coronavirus-Antigene exprimieren, um neue Impfstoffe zu entwickeln, und sie werden verwendet, um monoklonale Antikörpertherapeutika herzustellen, die neue Behandlungen für COVID-19 bieten könnten.
Rekombinante CHO-Zellen erzeugen
Entdecken Sie einen effektiven und schnellen Prozess zur Erzeugung rekombinanter CHO-Zelllinien
Die Auswahl von hochproduzierenden Säugetier-CHO-Zelllinien stellt weiterhin einen großen Engpass in der Verfahrensentwicklung für die Herstellung von Biopharmazeutika dar. Daher wird es immer wichtiger, neue High-Throughput-Methoden für die effiziente und kostengünstige Auswahl von hochexprimierenden CHO-Zelllinien zu entwickeln.
Entdecken Sie in dieser Application Note einen effektiven und schnellen Prozess zur Erzeugung rekombinanter CHO-Zelllinien, die hohe Mengen an therapeutischen Proteinen produzieren.
Application Note herunterladen

Molecular Devices bietet eine schnelle, einfache und umfassende Lösung für die Entwicklung von CHO-Zelllinien. Kombiniert mit dem CloneDetect Detektionsmittel, dem CloneSelect™ Imager und dem ClonePix™ System ermöglicht es Forschern eine effizientere Entwicklung neuer proteinbildender CHO-Zelllinien und damit eine schnellere Markteinführung.