
Beschleunigte Produktion von monoklonalen Antikörpern zur Behandlung von SARS-CoV-2
Mit Lösungen von Molecular Devices können Wissenschaftler den FDA-Zulassungsprozess beschleunigen und die Entdeckung monoklonaler Antikörper beschleunigen
Der Zeitplan zur Identifizierung und Entwicklung klinisch wirksamer neutralisierender Antikörper gegen Viruspartikel von Labor zu Patienten beträgt in der Regel 18 bis 24 Monate. Das weltweite Wettrennen um die Identifizierung wirksamer neutralisierender Antikörper gegen das Spike-Protein des SARS-CoV-2-Virus wurde zu einer Lebens- und Todessache, da die globale Todesfallzahl im ersten Jahr der COVID-19-Pandemie stieg.
Durch die Verwendung einer Kombination aus CloneSelect Instrumenten von Molecular Devices mit dem CloneSelect™ Single-Cell Printer™ und dem CloneSelect Imager kannder Zeitplan für die präklinische Entwicklung wirksamer neutralisierender Antikörper erheblich verkürzt werden. Tatsächlich spricht die Geschwindigkeit, mit der die pharmazeutische Welt monoklonale SARS-CoV-2-Antikörper herstellen und einsetzen konnte, für die Leistungsfähigkeit und das Versprechen der Automatisierung der Zelllinienentwicklung.
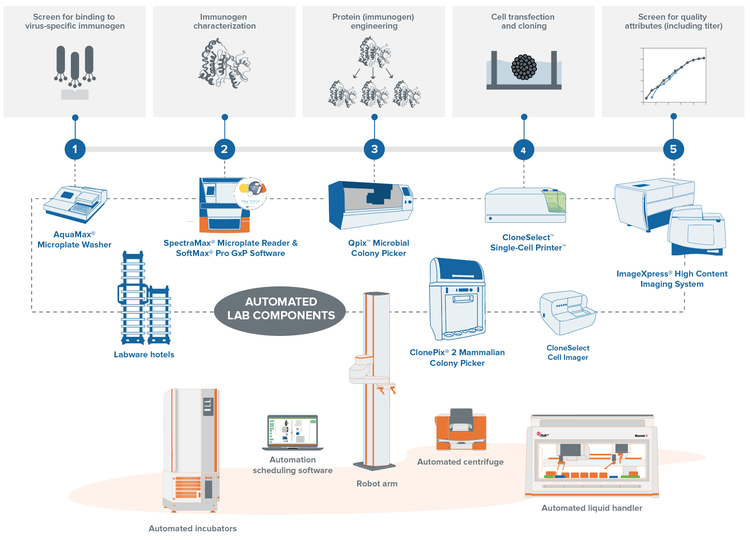
In diesem Artikel demonstrieren wir die Schritte zur Entwicklung monoklonaler Antikörper mit Instrumenten von Molecular Devices, von der klonalen Selektion über die Verfolgung des Zellwachstums bis hin zur bildbasierten Sicherstellung der Monoklonalität. Anschließend wird ein bildbasierter Monoklonalitätsbericht erstellt, der in weltweite Zulassungsanträge wie die Biologics License Application (BLA) bei der US Food and Drug Administration (FDA) aufgenommen wird.
Monoklonale Antikörper als Alternative zur Rekonvaleszenz-Plasmatherapie
In jüngster Zeit stehen monoklonale Antikörper, im Labor hergestellte Antikörper, die aus weißen Blutkörperchen kloniert wurden, für die Behandlung des SARS-CoV-2-Virus zur Verfügung. Das Wort „monoklonal“ beschreibt eine Zelllinie, die von einem einzigen Vorläufer (Einzelzelle) stammt und für die Zulassungsanmeldung einen Nachweis der Klonalität verlangt. Vorläufige Ergebnisse zeigten, dass diese Antikörper für mindestens 5-7 Monate immunologische Unterstützung bieten [ 5]. Angesichts des therapeutischen Potenzials ist die schnelle und effiziente Produktion monoklonaler Antikörper immer wichtiger geworden.
Es gibt ein Problem mit monoklonalen Antikörpern: die Zeit von der Entdeckung bis hin zu Machbarkeitsstudien. Der Zeitraum vom Nachweis des Antikörpers bis zur IND-Phase10-12I-Studie kann bis zu bis Monate dauern [ 6]. Durch die schnelle und effiziente Transfektion, Selektion und das Klon-Screening gibt es jedoch Möglichkeiten, den Prozess zu beschleunigen und die Produktionszeit um die Hälfte zu verkürzen.
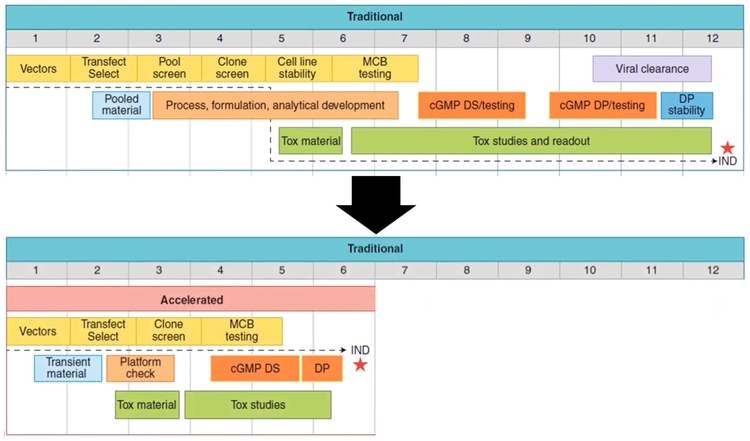
Abbildung 2 – Die Zeit von der Entdeckung bis zu Machbarkeitsstudien könnte von einem traditionellen Zeitplan von 5bis6 Monaten auf 10–12 Monate verkürzt werden.
Beschleunigter Arbeitsablauf zur Entwicklung monoklonaler Antikörper
Da die Vorschriften für die Entwicklung von Zelllinien immer strenger werden, müssen Forscher Einzelzellklonierungen durchführen und den Nachweis erbringen, dass eine Zelllinie aus einer einzigen Zelle stammt – Nachweis der Klonalität . Traditionelle Klonierungsmethoden (z. B. limitierende Verdünnung und FACS) verwenden statistische Analysen, um ein Konfidenzniveau für die Monoklonalität zu bestimmen. Die Dokumentation der Monoklonalität hat jedoch die Notwendigkeit für robustere Technologien und Methodiken bei Bioprozessen gesteigert. Viele Forscher verwenden heute routinemäßig Imaging-Systeme wie den CloneSelect Imager , um die Monoklonalität zu verifizieren und das Zellwachstum in Zellkulturmedien zu überwachen.
Ein idealer Produktionsablauf, der eine akzeptable Sicherstellung der Monoklonalität erzeugt, besteht aus den folgenden Schritten.
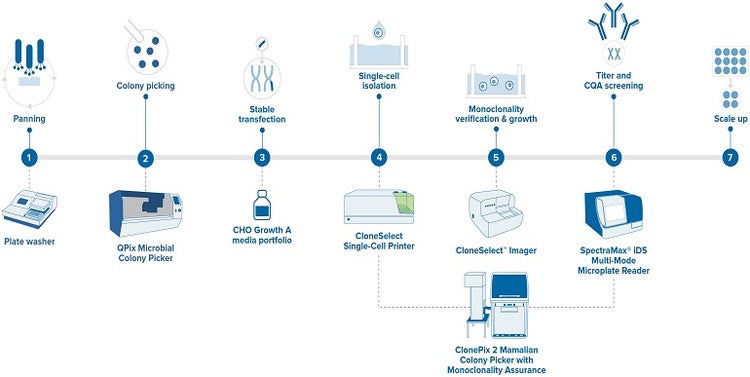
Abbildung 3 – Arbeitsablauf zur Entwicklung monoklonaler Antikörper
Herausforderung 1: Einzelzell-Isolierung
Der Schlüssel zur robusten Herstellung monoklonaler Antikörper ist die Isolierung einzelner hochleistungsfähiger Zellen. Es gibt jedoch verschiedene Herausforderungen bei der Einzelzellisolierung, wie z. B. die Gewinnung einer ausreichenden Anzahl an Zielzellen und die Aufrechterhaltung der Zellviabilität.
Die limitierende Verdünnung (Limiting Dilution, LD) ist eine traditionelle Isolierungsmethode, bei der die Stammzellkultur einer Reihe von Verdünnungen unterzogen wird, bis eine Zelle pro Platte in einem Well auf Grundlage von Wahrscheinlichkeitsberechnungen vorhanden ist. Der größte Nachteil liegt in der geringen Isolationseffizienz, d. h. die Anzahl der Zellen pro Platte schwankt zwischen Null und mehreren Zellen [ 7].
Die Durchflusszytometrie (FC) ist eine erfolgreichere Isolierungsmethode, die eine fluoreszenzaktivierte Zellsortierung implementiert. Sie beeinträchtigt jedoch die Überlebensfähigkeit der Zellen aufgrund von hohem Druck, Exposition gegenüber elektrischer Ladung und häufigen Hochgeschwindigkeitskollisionen. Die unüberlebensfähigen Bedingungen führen zu einer sogenannten sorterinduzierten zellulären Belastung (SICS) [ 8]. Wenn Sie also mit empfindlichen Zelltypen arbeiten, ist die durch die Durchflusszytometrie gewonnene Zelllinie möglicherweise nicht für die weitere Forschung geeignet und stellt Ihren Zeitplan um Monate zurück.
Die Mikrofluidik, der Prozess der Isolierung einzelner Zellen in mikrofluidischen Chips, hat sich zu einer effizienteren Alternative zu herkömmlichen Methoden entwickelt. Ein Faktor, der die Mikrofluidik hervorhebt, ist die massive Reduzierung der Eingangsvolumina, da Sie Ihre Proben in Mikroliter-Chips laden. Da die Mikrochips einen geringeren Sortierdruck haben, wird auch das SICS-Risiko reduziert. Schließlich eliminiert die Mikrofluidik das Risiko einer Kontamination von Probe zu Probe [ 9].
Vor kurzem haben wir die Einzelleffizienz dieser drei Methoden verglichen. Für den Nachweis der auf Mikrofluidik basierenden Isolierung haben wir unseren CloneSelect Single-Cell Printer verwendet, der die Technologie mit hochauflösendem Imaging kombiniert, um einzelne Zellen zu isolieren und gleichzeitig bildbasierte Nachweise der Monoklonalität aufzuzeichnen. Wie Sie dem untenstehenden Balkendiagramm entnehmen können, übertraf der CloneSelect Single-Cell Printer LD und FC um das 8-fache bzw10. 20-%.
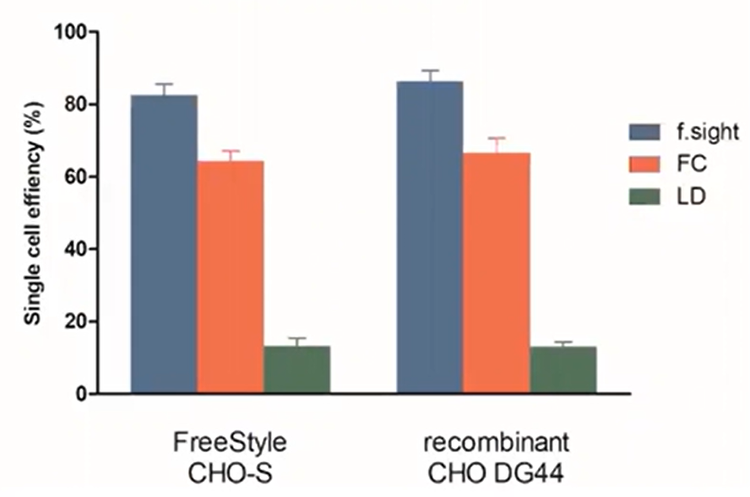
Abbildung 4 – Einzelzelleffizienz: Der f-sight hat eine überlegene Beschichtungseffizienz gegenüber LD und FC.
Herausforderung2: Effizienz des kolonialen Auswuchses
Die nächste Frage lautet: Wie lässt sich die Effizienz von Einzelzellen bei der Erzeugung monoklonaler Kolonien umsetzen?
Für den Vergleich des kolonialen Auswuchses von Mikrofluidik mit LD und FC verwendeten wir den CloneSelect Imager , mit dem wir die Teilung von einer einzigen Zelle 90 aus Sekunden lang scannen konnten. Der CloneSelect Imager lieferte als Beweis sowohl Diagrammstatistiken als auch visuelle Miniaturansichten des Zellwachstums. Da der CSI das anschließende Scannen der Platte über 14 Tage ermöglicht, können Sie leicht vom letzten Bild bis zum Tag Null zurückverfolgen, um nachzuweisen, dass die Kolonie tatsächlich aus einer einzigen Zelle gebildet wurde. Darüber hinaus können Sie Ihre Koloniebilder als PDF- oder Word-Bericht zur bildbasierten Sicherstellung der Monoklonalität exportieren.
Wie trägt dies also dazu bei, den Zeitplan zu verkürzen? Anstelle einer Zwei-Runden-Isolierung zur Gewährleistung einer wahrscheinlichkeits- und bildbasierten Sicherheit könnten Sie einen Einzelzellendrucker und einen Bildsensor synergistisch für eine Klonrunde verwenden. Bei dieser Methode wurde nachgewiesen, dass sie eine Monoklonalitätssicherung mit über 99,99% Konfidenz verleiht [ 10].
Die Ergebnisse der Auswuchseffizienz sind im Folgenden sowohl für Freestyle- als auch für rekombinante CHO-Zellen dargestellt.
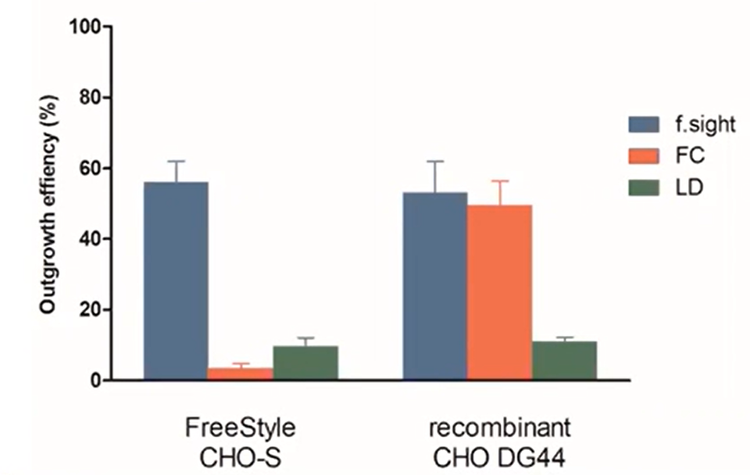
Abbildung 5 – Effizienz des kolonialen Auswuchses: Die f.sight zeigt im Vergleich zur herkömmlichen limitierenden Verdünnung eine fünffache Verbesserung des klonalen Auswuchses.
Ähnlich wie bei der Einzelzelleffizienz schnitt die LD bei beiden Zelllinien schlecht ab. Interessanterweise wies der FC in rekombinanten Zellen eine fast gleiche Effizienz auf wie der CloneSelect Single-Cell Printer, in Zellen mit freiem Stil jedoch 15-mal schlechter. Dies weist eindeutig darauf hin, dass der CloneSelect Single-Cell Printer™ in Kombination mit der CloneSelect® Imager Technologie im Hinblick auf das Auswachsen der Kolonnen konsistenter ist als FC.
Herausforderung3: Monoklonalität und Sekretion im großen Maßstab
Die Isolierung von Kandidaten für Säugetierzellklone kann anstrengend und zeitaufwendig sein, da Sie Hunderttausende von Klonen nicht nur auf Monoklonalität, sondern auch auf eine ausreichende Antikörpersekretion screenen müssen.
Molecular Devices hat das ClonePix® System für einen automatisierten End-to-End-Zelllinienentwicklungs-Arbeitsablauf mit Nachweis der Monoklonalität entwickelt. Das ClonePix System ist für das Screening und die Quantifizierung neutralisierender Antikörper aus einer großen Anzahl von CHO-Klonen in situ ausgestattet. Die Software verwendet eine Fluoreszenzdetektionssonde zur Quantifizierung der Sekretion und nimmt die Klone mit der höchsten Ausbeute automatisch auf.
Wie unten dargestellt, übertrifft der ClonePix® LD in mehreren Aspekten. Es kann nicht nur eine wesentlich größere Anzahl an Kolonien mit weniger Platten screenen, sondern auch Kolonien mit höheren Ausbeuten aufnehmen.
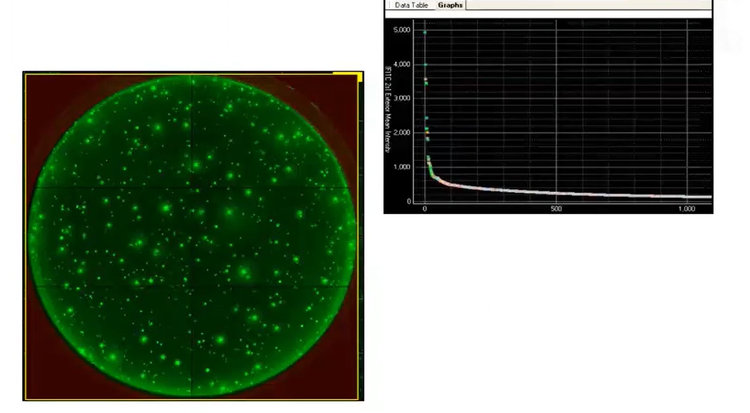
Abbildung 6 – ClonePix: In situ ermöglicht die Bestimmung der Produktivität eher das kumulative Datum als den einmaligen Zeitpunkt.
Wie sieht es mit der Zeitachsenreduktion aus? Die Originalversion des Arbeitsablaufs des ClonePix2 Säugetierkolonie-Pickers erfordert, wie von der FDA vorgeschlagen, zwei Screening-Runden in Verbindung mit der Kombination aus CloneSelect Single-Cell Printer und Imager.
Erkunden Sie Arbeitsabläufe, die für die Laborautomatisierung geeignet sind
Lassen Sie uns Ihre Ideen verwirklichen! Unser Team für Individualisierung und Automatisierung hat den ClonePix 2 Säugetierkolonie-Picker auf Anfrage erfolgreich für Kunden angepasst – einschließlich Software und Hardware. Durch die Aktualisierung des Systems mit zusätzlichen Funktionen zur Sicherstellung monoklonaler Antikörper kann beispielsweise ein einziges Instrument alle Anforderungen an den Arbeitsablauf der Herstellung monoklonaler Antikörper erfüllen, vom Antikörper-Screening bis hin zum Titer mit einer Runde Klon-Screening.
Mit den automatisierten Arbeitsabläufen für das Screening von Klonen von Molecular Devices können Sie die Belastung Ihres Labors verringern, indem Sie die praxisnahe Arbeit erheblich reduzieren und gleichzeitig ein zentrales Repository für Daten aus mehreren Prozessen erstellen. Unsere automatisierten Lösungen vereinen alle Ihre Laborinstrumente und steigern dadurch Ihren Durchsatz, während sie gleichzeitig die Notwendigkeit des manuellen Eingreifens durch Personen verringern.
Quellenangaben
- Mair-Jenkins, John, et al. „Die Wirksamkeit von Rekonvaleszentenplasma und Hyperimmun-Immunglobulin zur Behandlung schwerer akuter Atemwegsinfektionen viraler Ätiologie: eine systematische Überprüfung und eine explorative Meta-Analyse.“ The Journal of Infectious Diseases 211,1 ( 2015): 80-90.Mair-Jenkins, John, et al. „Die Wirksamkeit von Rekonvaleszentenplasma und Hyperimmun-Immunglobulin bei der Behandlung schwerer akuter Atemwegsinfektionen viraler Ätiologie: eine systematische Überprüfung und eine explorative Meta-Analyse.“ The Journal of Infectious Diseases 211,1 (2015): 80-90.
- Ko, Jae-Hoon, et al. „Herausforderungen der Rekonvaleszenz-Plasmainfusionstherapie bei Atemwegs-Coronavirus-Infektionen im Nahen Osten: eine Erfahrung in einem einzigen Zentrum.“ Antivirentherapie 23,7 ( 2018): 617-622.Ko, Jae-Hoon, et al. „Herausforderungen der Rekonvaleszenten-Plasmainfusionstherapie bei Atemwegs-Coronavirus-Infektionen im Nahen Osten: eine Erfahrung in einem einzigen Zentrum.“ Antivirenwirkstoff 23,7 (2018): 617-622.
- Shen, Chenguang, et al. „Behandlung 5 schwerkranker Patienten mit COVID-19 mit Rekonvaleszentem Plasma.“ Jama 323,16 ( 2020): 1582-1589.Shen, Chenguang, et al. „Behandlung 5 schwerkranker Patienten mit COVID-19 mit Rekonvaleszentenplasma.“ Jama 323,16 (2020): 1582-1589.
- Gontu, Abhinay, et al. „Begrenztes Zeitfenster für die Spende von Rekonvaleszentenplasma mit hohen neutralisierenden Lebendvirus-Antikörpertitern für die COVID-19-Immuntherapie.“ Kommunikationsbiologie 4,1 ( 2021): 1-9.Gontu, Abhinay, et al. „Begrenztes Zeitfenster für die Spende von Rekonvaleszentenplasma mit hohen neutralisierenden Lebendvirus-Antikörpertitern für die COVID-19-Immuntherapie.“ Kommunikationsbiologie 4,1 (2021): 1-9.
- Ripperger, Tyler J., et al. „Orthogonale serologische SARS-CoV-2-Assays ermöglichen die Überwachung von Gemeinschaften mit geringer Prävalenz und zeigen eine dauerhafte humorale Immunität.“ Immunität 53,5 ( 2020): 925-933.Ripperger, Tyler J., et al. „Orthogonale serologische SARS-CoV-2-Assays ermöglichen die Überwachung von Gemeinschaften mit geringer Prävalenz und zeigen eine dauerhafte humorale Immunität.“ Immunität 53,5 (2020): 925-933.
- Kelley, Brian. „Die Entwicklung therapeutischer monoklonaler Antikörper im Pandemietempo.“ Natur-Biotechnologie 38,5 ( 2020): 540-545.Kelley, Brian. „Die Entwicklung therapeutischer monoklonaler Antikörper im Pandemietempo.“ Nature Biotechnology 38,5 (2020): 540-545.
- Heisler, E., und H. W. Vohr. „3D Human Skin/Epidermal Models and Organotypic Human and Murine Skin Explant Systems. Die zyklische Referenz der Immuntoxikologie.“ (2005).Heisler, E., und H. W. Vohr. „3D Human Skin/Epidermal Models and Organotypic Human and Murine Skin Explant Systems. Die enzyklopedische Referenz der Immuntoxikologie.“ (2005).
- Hu, Ping, et al. „Einzelzellisolierung und -analyse“. Grenzen in der Zell- und Entwicklungsbiologie 4 ( 2016): 116.Hu, Ping, et al. „Einzelzellisolierung und -analyse“. Grenzen in der Zell- und Entwicklungsbiologie 4 (2016): 116.
- Gross, Andre, et al. „Technologien für die Isolierung einzelner Zellen“. Internationale Fachzeitschrift für Molekularwissenschaften 16,8 ( 2015): 16897-16919.Gross, Andre, et al. „Technologien für die Isolierung von Einzelzellen“. Internationale Fachzeitschrift für Molekularwissenschaften 16,8 (2015): 16897-16919.
- Yim, Mandy und David Shaw. „Durch die Kombination von Zelldruck- und Platten-Imaging-Technologien wird eine höhere Effizienz und ein höheres Vertrauen in das Klonen von Einzelzellen erzielt.“ Fortschritte in der Biotechnologie 34,6 ( 2018): 1454-1459.Yim, Mandy und David Shaw. „Durch die Kombination von Zelldruck- und Platten-Imaging-Technologien wird eine höhere Effizienz und ein höheres Vertrauen in das Klonen von Einzelzellen erzielt.“ Fortschritte in der Biotechnologie 34,6 (2018): 1454-1459.