Stammzellforschung und regenerative Medizin – auf der ISSCR 2022 vorgestellte Technologie und Methoden
Es war ein weiteres großartiges Jahr bei der ISSCR 2022! Führungskräfte aus der ganzen Welt kamen zusammen, um neue Technologien zu diskutieren, Erkenntnisse auszutauschen und die neuesten Durchbrüche in der Stammzellforschung und der regenerativen Medizin zu erforschen. Darüber hinaus lernten die Teilnehmer automatisierte und quantifizierbare Lösungen für die Komplexität von 3D-Zellmodell-Assays kennen.
Falls Sie die Show verpasst haben oder weitere Einzelheiten über die vorgestellten Technologien und Methoden wünschen – wir haben alles für Sie!
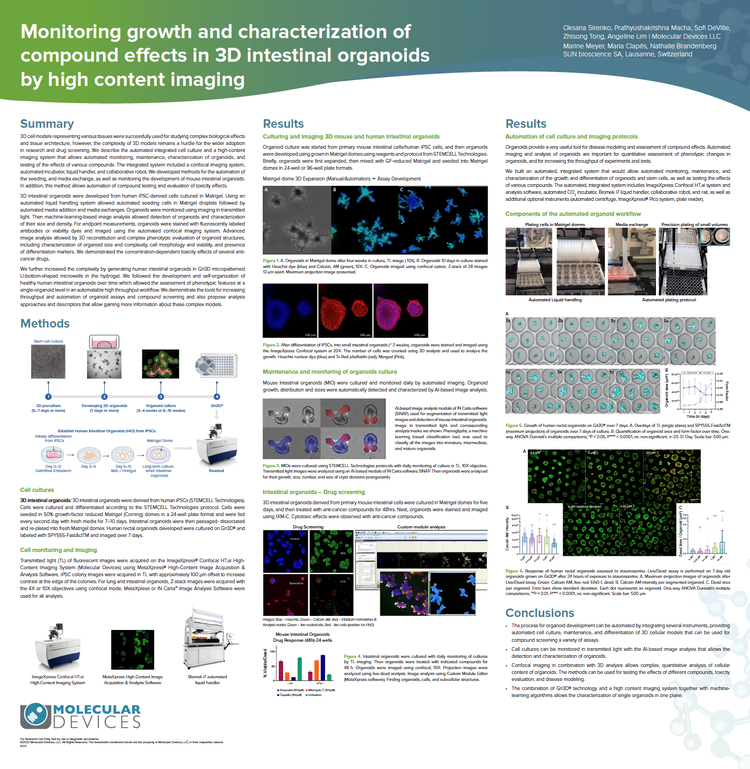
Überwachung des Wachstums und der Charakterisierung von Verbindungseffekten in 3D-Darmorganoiden mit High-Content-Imaging
Wir entwickelten Methoden zur Automatisierung der Aussaatzellen in Matrigel und zum Medienaustausch sowie zur Überwachung der Entwicklung von Darmorganoiden von Maus mittels Imaging im Durchlicht. Die auf maschinellem Lernen basierende Bildanalyse ermöglichte die Erkennung von Organoiden und die Beschreibung ihrer Größe und Dichte. Die fortschrittliche Bildanalyse ermöglichte die 3D-Rekonstitution und komplexe phänotypische Evaluierung von Organoidstrukturen, einschließlich der Beschreibung der Größe und Komplexität der Organoide, der Zellmorphologie und -viabilität sowie des Vorhandenseins von Differenzierungsmarkern. Wir demonstrieren die konzentrationsabhängigen Toxizitätseffekte mehrerer Krebsmedikamente.
Wir haben die Komplexität weiter erhöht, indem wir menschliche Darmorganoide in mikrogemusterten Gri3D® U-Boden-förmigen Mikroschälchen im Hydrogel erzeugt haben. Wir demonstrieren die Werkzeuge zur Steigerung des Durchsatzes und der Automatisierung von Organoid-Assays und des Screenings von Verbindungen und schlagen Analyseansätze und Deskriptoren vor, die mehr Informationen über diese komplexen Modelle liefern.
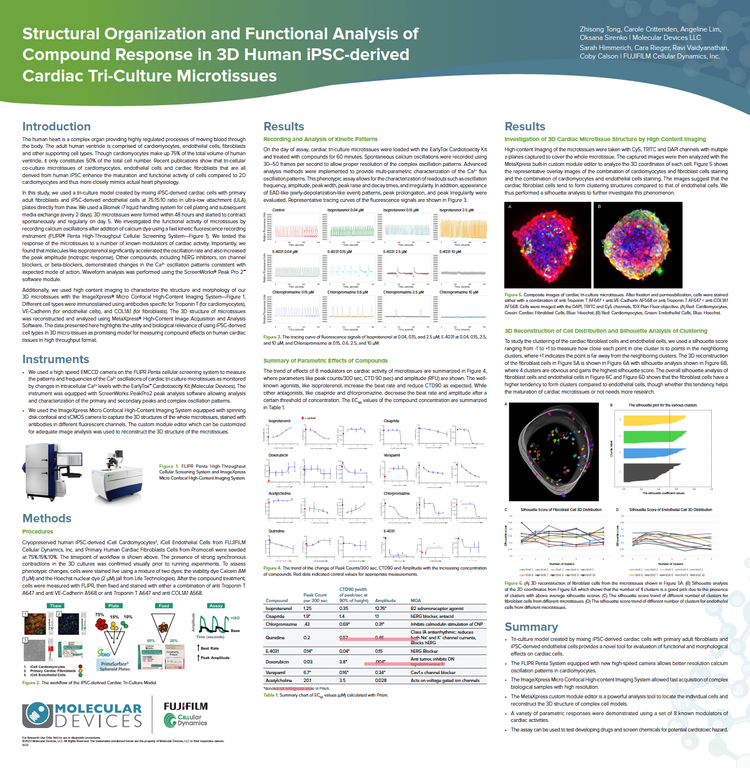
Strukturelle Organisation und funktionelle Analyse der Antwort von Verbindungen in aus 3D-humanen iPSC gewonnenen kardialen Trikultur-Mikrogeweben
In dieser Studie verwendeten wir ein Trikulturmodell, das durch das Mischen von aus iPSC gewonnenen Herzzellen mit primären adulten Fibroblasten und aus iPSC gewonnenen Endothelzellen erstellt wurde. Wir verwendeten ein Biomek i7 Liquid Handling System für die Zellplattierung und den anschließenden Medienaustausch. Wir untersuchten die funktionelle Aktivität von Mikrogeweben, indem wir Calcium-Oszillationen mit einem schnellen kinetischen Fluoreszenz-Aufzeichnungsgerät – dem FLIPR® Penta High-Throughput Cellular Screening System – aufzeichneten, während die Wellenformanalyse mit dem ScreenWorks® Peak Pro 2™ Softwaremodul durchgeführt wurde. Darüber hinaus haben wir High-Content-Imaging verwendet, um die Struktur und Morphologie unserer 3D-Mikrogewebe mit dem ImageXpress® Micro Confocal High-Content Imaging Systemzu charakterisieren. Die 3D-Struktur von Mikrogeweben wurde mit der MetaXpress® High-Content Image Acquisition and Analysis Software rekonstruiert und analysiert.
Die hier präsentierten Daten unterstreichen die Nützlichkeit und biologische Relevanz der Verwendung von aus iPSC gewonnenen Zelltypen in 3D-Mikrogeweben als vielversprechendes Modell zur Messung von Verbindungseffekten auf menschlichem Herzgewebe in einem High-Throughput-Format.
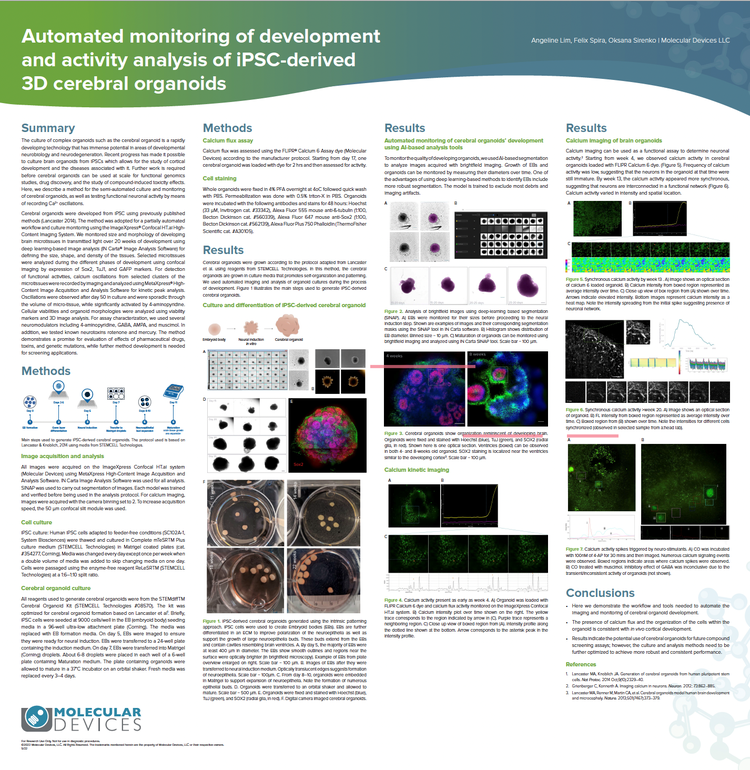
Automatisierte Überwachung der Entwicklung und Analyse der Aktivität von aus iPSC gewonnenen 3D-Gehirn-Organoiden
Zerebrale Organoide wurden aus iPSC unter Verwendung zuvor veröffentlichter Methoden entwickelt (Lancaster 2014). Die Methode wurde für einen teilweise automatisierten Arbeitsablauf und die Kulturüberwachung mit dem ImageXpress Confocal HT.ai High-Content Imaging System angewendet. Wir haben die Größe und Morphologie der Entwicklung von Gehirn-Mikrogeweben im Durchlicht über 20 Wochen der Entwicklung hinweg mithilfe einer auf Deep Learning basierenden Bildanalyse (IN Carta® Image Analysis Software) überwacht, um die Größe, Form und Dichte des Gewebes zu bestimmen. Zur Detektion funktioneller Aktivitäten wurden Calcium-Oszillationen aus ausgewählten Clustern der Mikrogewebe mittels Imaging aufgezeichnet und mit MetaXpress High-Content Image Acquisition and Analysis Softwar e für die kinetische Peak-Analyse analysiert.
Die Methode erweist sich als vielversprechend für die Evaluierung der Auswirkungen von pharmazeutischen Wirkstoffen, Toxinen und genetischen Mutationen, während für Screening-Anwendungen eine weitere Methodenentwicklung erforderlich ist.
Werfen Sie einen Blick darauf, wo unsere Forschung stattfindet!
Besichtigen Sie unser Organoid Innovation Center, in dem wir modernste Instrumente präsentieren, die harmonisch zusammenarbeiten, um das Wachstum und die Überwachung von 2D- und 3D-Lebendzellkulturen mit intelligentem labelfreiem Imaging zu ermöglichen. Dieser integrierte Arbeitsablauf bietet Qualitätskontrollwarnungen und -bereitschaft, 3D-Organoid-Screening und Deep-Learning-Bildanalyse, die verborgene Muster aufdecken, die andere Technologien verpassen.