Die Geschichte der Organoid-Forschung: von Schwammzellen zu funktionierenden Organoiden
Beginnen wir mit einer einfachen Definition eines Organoids, die sich auf eine dreidimensionale Einheit bezieht, die mehrere Zelltypen enthält, die zumindest im Mikromaßstab mit realistischer Histologie angeordnet sind. Organoide können aus menschlichen oder tierischen Zellen gebildet werden, die aus differenzierten Zellen, Stammzellen oder einer Mischung aus beidem bestehen können.
Der zunehmende Einsatz von Organoiden wird durch die schnelle Entwicklung von Stammzellen und den Wunsch, den Einsatz von Tiermodellen zu reduzieren, angetrieben. Organoide werden bereits verwendet, um Methoden zur Krankheitsentwicklung zu verstehen, Neoplasien (Krebs), wichtige medizinische und industrielle Anwendungen (z. B. Toxikologie) und letztendlich Transplantationen. Kerry Grens, ein Autor am The Scientist Magazine, nannte Organoide als eines der „Fortschritte des Jahres“.1 Organoide wurden bereits entwickelt, um viele verschiedene Teile des menschlichen Körpers zu repräsentieren, wobei davon auszugehen ist, dass die Anwendungen in den nächsten Jahren wachsen werden.

Geschichte der Organoidforschung
3D-Organoide stehen unbestreitbar im Zentrum der Krankheitsmodellierung und Wirkstoffforschung. Da diese Zellkulturen sich selbst zu Clustern organisieren und sich zu Zelltypen differenzieren, die ein funktionelles Organ bilden, sind sie bei der Nachahmung von In-vivo-Bedingungen viel besser.
Interessanterweise ist die Idee von Organoiden nicht neu. Die heutige Organoid-Technologie ist das Produkt jahrzehntelanger Forschung. Die Grundlagen dieses Konzepts reichen bis ins 20. Jahrhundert zurück.
Hier ist ein kurzer Überblick über die Geschichte der Organoide und darüber, wie Molecular Devices mit seinen umfassenden Lösungen für die Organoidforschung einen Platz auf der Zeitleiste gefunden hat.
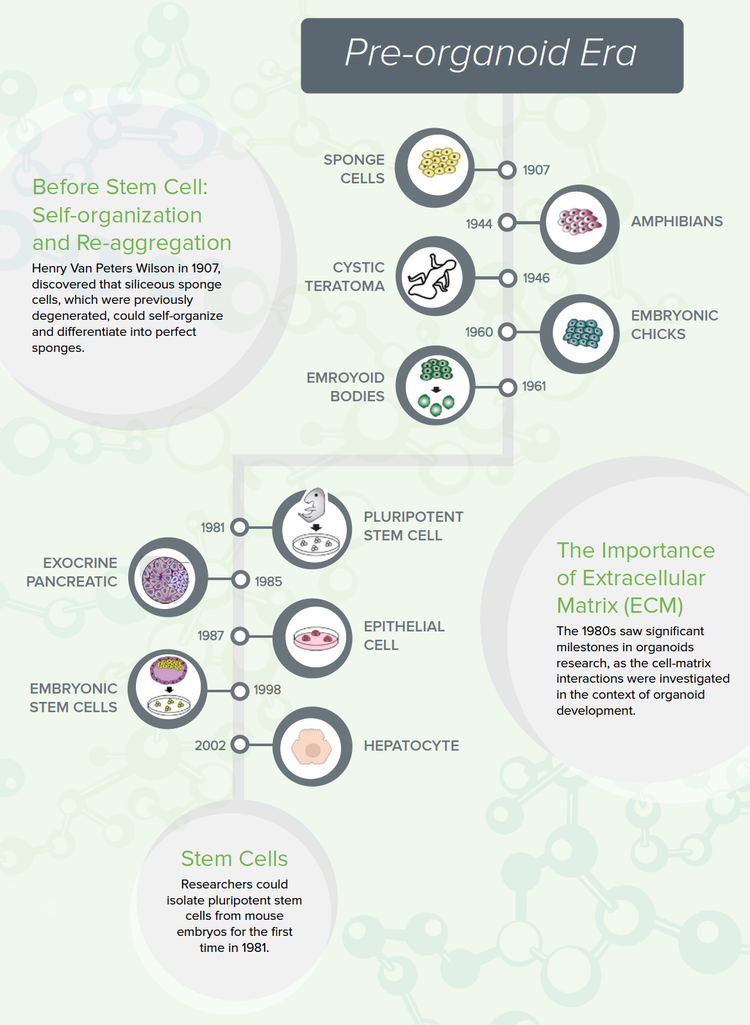
Vor der Stammzelle: Selbstorganisation und Reaggregation
Die Selbstorganisation von Zellen wurde erstmals von Henry Van Peters Wilson im Jahr beobachtet1907. Während er für das US Bureau of Fisheries forschte, stellte er fest, dass unter bestimmten Bedingungen siliziumhaltige Schwammzellen zu undifferenzierten Gewebemassen degenerieren, die sich wiederum selbst organisieren und sich zu perfekten Schwämmen differenzieren könnten.2 Dieses Experiment hat gezeigt, dass Zellen die Informationen enthalten, um eine multizelluläre Struktur ohne äußere Hinweise oder die Notwendigkeit einer spezifischen anatomischen Anordnung zu schaffen.
In den folgenden Jahrzehnten beobachteten andere Forschungsgruppen ähnliche Dissoziations-Reaggregationsmuster mit kosteneffektiven und gut untersuchten Organismen, wie Amphibian Pronephros (primitive Niere) in 19443und embryonale Kükenzellen in 1960.4 Diese Experimente zeigten, dass die von Wilson beobachtete Selbstorganisation auch in Wirbelmodellen auftritt.
Die erste wissenschaftliche Theorie zur Zellregeneration trat auf1964, als Malcolm Steinberg die Hypothese aufstellte, dass die Zellen sich selbst organisieren, und zwar nach der „Thermodynamik, die durch die differenzielle Oberflächenadhäsion vermittelt wird“.5 Er schlug vor, dass Zellen, die dasselbe „Klebesystem“ exprimieren, stärker aneinander haften als Zellen, die verschiedene Klebstoffsysteme exprimieren. Daher würden sich Zellgemische basierend auf ihrem „Klebe“-Typ reaggregieren. Spätere Beweise haben jedoch gezeigt, dass die Zellulärreaggregation mehr als einfache Thermodynamik und zusätzliche zelluläre Mechanismen erfordert.
Laden Sie die Infografik herunter
Die Bedeutung der extrazellulären Matrix (ECM)
In den 1980er Jahren wurden bedeutende Meilensteine in der Organoidforschung erreicht, da die Zellmatrix-Interaktionen im Zusammenhang mit der Organoidentwicklung untersucht wurden.
Um zu verhindern, dass die Zellkultur durch die Kunststoffschale kontaminiert wird, begannen die Forscher, Gerüste, Hydrogele, die das natürliche ECM imitieren, zu verwenden. Noch wichtiger ist, dass ein ECM die Zelle mit Proteinen versorgt, die für die Signaladhäsion und -differenzierung erforderlich sind.
Im Jahr wurde 1987die Bedeutung von ECM von Li et al. hervorgehoben, die EHS-Matrigel (Engelbreth-Holm-Swarm) aus Maus-Sarkomzellen verwendete, das aus haftenden Proteinen besteht, die üblicherweise in humanen ECM vorkommen. Mithilfe des EHS-Mediums konnten sie Brustepithelien in vollständig ausgebildete 3D-Kanäle und Ductuli wachsen lassen, die eine Milchproteinsekretion aufwiesen.6
Shannon et. al. verwendeten dieselbe ECM-Strategie, um die funktionelle Differenzierung von alveolären Epithelzellen des Typs II zu demonstrieren.7
Stammzellforschung
Vor der Entwicklung von Stammzellen hing die Bildung von menschlichen Organoiden von der Verwendung von Gewebefragmenten ab, die vom Menschen isoliert wurden. Die Stammzellforschung florierte in den 80er Jahren gleichzeitig. Forscher konnten zum Beispiel erstmals im Jahr pluripotente Stammzellen von Mausembryos isolieren1981.
Die Entwicklung der ersten humanen embryonalen Stammzelllinien (Thomson et al.1998) und späterer humaninduzierter pluripotenter Stammzelllinien (hiPSC) waren entscheidend für das Interesse an der Organoidforschung. Noch wichtiger ist, dass hiPSC in einem Medium, das mit spezifischen8 Wachstumsfaktoren konditioniert ist, in eine Vielzahl von Zelltypen differenziert werden kann, die die Ausgangsstoffe für das Wachstum von Organoiden im großen Maßstab darstellen. Der zeitliche und zeitliche Faktor war ebenfalls für die Bildung von Organoiden wichtig. Diese Beobachtungen waren mehr als ausreichend, um Stammzellen an die Spitze der Organoidforschung zu bringen.
Induzierte pluripotente Stammzellen (iPSCs)
Eine induzierte pluripotente Stammzelle, auch als iPS-Zelle oder iPSC bezeichnet, ist eine Zelle, die aus adultem Gewebe – üblicherweise aus Haut- oder Blutzellen gewonnen – entnommen und genetisch in einen embryonalen, pluripotenten Zustand zurückversetzt wird. Die iPS-Zellen wurden erstmals von Shinya Yamanakas Team an der Kyoto University, Japan2006,9 aus Mäusehautzellen entwickelt und hielten sich im Bereich der regenerativen Medizin als vielversprechend.
Pluripotente Stammzellen können sich auf unbestimmte Zeit vermehren oder selbst erneuern und sich in jeden adulten Zelltyp im Körper, wie Neuronen oder Herz-, Pankreas- und Leberzellen, differenzieren. Da iPSCs direkt aus adulten Geweben gewonnen werden können, können sie patientenspezifisch hergestellt werden, was bedeutet, dass wichtige krankheitsbezogene Zellmodelle erstellt werden können, die ein mutiertes Gen tragen, das die Wirksamkeit von Wirkstoffen untersuchen kann, oder die Arzneimittelempfindlichkeit eines einzelnen Patienten in von Patienten stammenden Zellen getestet werden kann. Möglicherweise hat jeder Einzelne eine eigene pluripotente Stammzelllinie, die eine einzige Zellquelle bietet, um geschädigtes Herz- oder Lebergewebe zu ersetzen. Stellen Sie sich iPSCs vor, die aus Blutzellen erzeugt werden, die für einen Leukämiepatienten neues Blut frei von Krebszellen oder Neuronen zur Behandlung neurologischer Erkrankungen erzeugen könnten.

Laden Sie die Infografik herunter
Nach Stammzelle: Moderne Organoidforschung
Die Isolierung von Stammzellen beschleunigt die Organoidforschung und öffnete viele Türen. Aus Stammzellen gewonnene Organoide waren bei der Überwachung der Immunantwort viel effektiver als Patientenbiopsien, was bedeutet, dass sie für die Krankheitsmodellierung viel aufschlussreicher waren.
2008legte Sasai et.al die Grundlagen für Gehirnorganoide, indem er die Selbstorganisation menschlicher Gehirn-iPSCs in neuronale Zellen demonstrierte, die polarisiertes kortikales Gewebe bildeten.10
2009 war ein weiteres bedeutendes Jahr für die moderne Organoidforschung. Sato et al. demonstrierten zum ersten Mal, dass intestinale adulte Stammzellen (ASCs) sich selbst organisieren und differenzieren konnten, um intestinale Krypta-Villus-Strukturen zu bilden, die alle verschiedenen intestinalen Zelltypen enthielten.11
Drei Jahre später pflanzte dasselbe Forschungslabor auch die Samen der Stammzelltherapie, indem es die Transplantationsfähigkeit von Darmorganoiden in ein geschädigtes Mauskolon demonstrierte. Die transplantierten Organoide konnten sich auch nach sechs Monaten vollständig in das Mauskolon integrieren und konnten so nachhaltig erfolgreich sein.12
Laden Sie die Infografik herunter
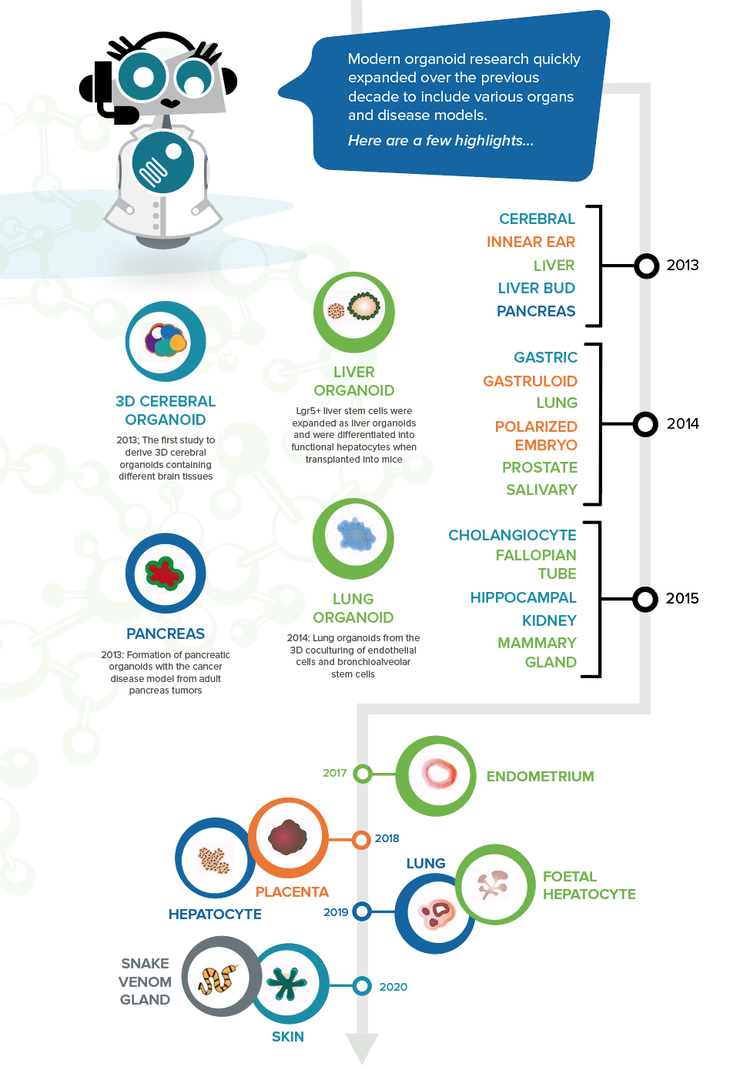
Die moderne Organoidforschung wuchs im Verlauf der letzten zehn Jahre schnell und umfasste verschiedene Organe und Krankheitsmodelle. Hier sind einige Highlights:
- 2010 – Nierenorganoide aus murinen, vom Fötus stammenden Nierenstammzellen 13
- 2012 – Bildung einer selbstorganisierten optischen Becherstruktur aus humanen ESCs in 3D-Kultur
- 2013 – Die erste Studie zur Ableitung von 3D-Hirnorganoiden mit verschiedenen Gehirngeweben 14
- 2014 – Lungenorganoide aus der 3D-Co-Kultur von Endothelzellen und bronchioalveolären Stammzellen 15
- 2013 – Lgr5+-Leberstammzellen wurden als Leberorganoide expandiert und bei der Transplantation in Mäuse in funktionelle Hepatozyten differenziert 16
- 2013 – Bildung von Pankreas-Organoiden mit dem Krebs-Krankheits-Modell aus adulten Pankreastumoren 17
Organoid-Bildgalerie
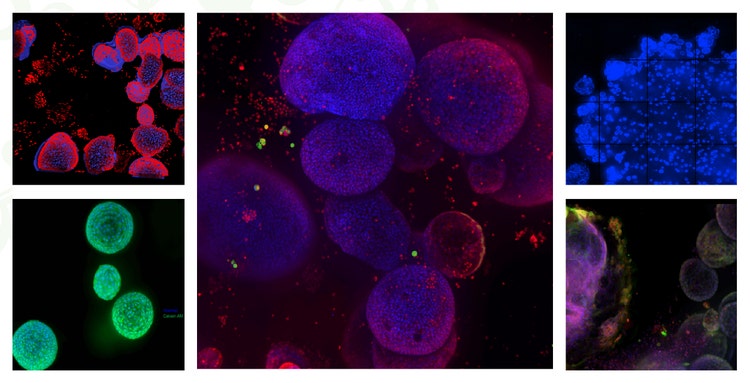
Weitere Bilder finden Sie auf unserer Organoids-Anwendungsseite.
Organoid-Forschung bei Molecular Devices
In den letzten zehn Jahren sind die Fortschritte in der Entwicklung von Organoiden in die Höhe geschnellt und haben komplexere und lebensechte Organoide erzeugt als je zuvor. Unweigerlich müssen Imaging- und Analysetechniken mit den kontinuierlichen Entwicklungen Schritt halten. Da die Probentypen von 2D- auf 3D-Zellmodellen umgestellt werden, werden konventionelle Methoden qualitativ hochwertige Ergebnisse und eine schnelle Erfassung nicht liefern.
Molecular Devices ist bestrebt, die Organoid-Forschung durch die Integration automatisierter Charakterisierung, High-Content-Imaging und fortschrittlicher Analysetechniken in eine High-Throughput-Plattform wesentlich realisierbarer zu machen. Diese Plattform hat es uns ermöglicht, Arbeitsabläufe für eine Vielzahl von Operationen zu automatisieren, wie z. B. Stammzellerzeugung, Organoidcharakterisierung, Wirkstoffscreening und Toxizitätsbewertung, und zwar bei verschiedenen Organoidtypen von der Lunge bis zum Gehirn.

https://main--moleculardevices--hlxsites.hlx.page/applications/organoid-innovation-center
Besuchen Sie unsere Organoids-Anwendungsseite, um detaillierte Organoid-Forschungsnotizen, Webinare, Poster und mehr zu erhalten.
Das Beste daran ist, dass Sie keine Experten für diese Lösungen sein müssen. Das neue Organoid Innovation Center von Molecular Devices ist ein kollaboratives Zentrum, in dem Sie automatisierte Arbeitsabläufe für die Kultivierung und das Screening von Organoiden unter Anleitung von internen Wissenschaftlern testen können.
Besuchen Sie das Organoid Innovation Center, um mehr über die Einblicke in Organoide, automatisierte Arbeitsabläufe und bahnbrechende Zusammenarbeit zu erfahren.
Quellenangaben
- Grens, K. „Die großen Fortschritte in der Wissenschaft 2013. The Scientist, New York City ( 2013): 110.Grens, K. „Die großen Fortschritte in der Wissenschaft 2013. The Scientist, New York City (2013): 110.
- Wilson, H. V. „Eine neue Methode, mit der Schwämme künstlich aufgezogen werden können.“ Wissenschaft 25,649 ( 1907): 912-915.Wilson, H. V. „Eine neue Methode, mit der Schwämme künstlich aufgezogen werden können.“ Wissenschaft 25,649 (1907): 912-915.
- Holtfreter, Johannes. „Experimentelle Studien zur Entwicklung der Pronephros.“ Rev. Dosen-Biol. 3 (1943): 220-250.Holtfreter, Johannes. „Experimentelle Studien zur Entwicklung der Pronephros.“ Rev.-Dosen biol. 3 (1943): 220-250.
- Weiss, Paul und A. C. Taylor. „Rekonstitution vollständiger Organe aus Einzelzellsuspensionen von Kükenembryos in fortgeschrittenen Differenzierungsphasen.“ Verfahren der National Academy of Sciences of the United States of America 46,9 ( 1960): 1177.Weiss, Paul und A. C. Taylor. „Rekonstitution vollständiger Organe aus Einzelzellsuspensionen von Kükenembryos in fortgeschrittenen Differenzierungsstadien.“ Verfahren der National Academy of Sciences of the United States of America 46,9 (1960): 1177.
- Steinberg, Malcolm S. „The problem of adhesive selectivity in cellular interactions“. Zellmembranen in der Entwicklung. Vol. 22. Akademische Presse New York, 1964. 321-366.Steinberg, Malcolm S. „The problem of adhesive selectivity in cellular interactions“. Zellmembranen in der Entwicklung. Vol. 22. Akademische Presse New York, 1964. 321-366.
- Li, Ming Liang, et al. „Einfluss einer rekonstituierten Basalmembran und ihrer Komponenten auf die Expression und Sekretion von Kaseingenen in Epithelzellen der Maus.“ Verfahren der National Academy of Sciences 84,1 ( 1987): 136-140.Li, Ming Liang, et al. „Einfluss einer rekonstituierten Basalmembran und ihrer Komponenten auf die Expression und Sekretion von Kaseingenen in Epithelzellen der Maus.“ Verfahren der National Academy of Sciences 84,1 (1987): 136-140.
- Shannon, John M., Robert J. Mason und Susan D. Jennings. „Funktionale Differenzierung von Epithelzellen des alveolären Typs II in vitro: Auswirkungen der Zellform, Zellmatrix-Interaktionen und Zell-Zell-Interaktionen.“ Biochimica et Biophysica Acta (BBA)-Molekulare Zellforschung 931,2 ( 1987): 143-156.Shannon, John M., Robert J. Mason und Susan D. Jennings. „Funktionale Differenzierung von alveolären Epithelzellen des Typs II in vitro: Auswirkungen der Zellform, Zellmatrix-Interaktionen und Zell-Zell-Interaktionen.“ Biochimica et Biophysica Acta (BBA)-Molekulare Zellforschung 931,2 (1987): 143-156.
- Martin, Gail R. „Isolierung einer pluripotenten Zelllinie aus frühen Mausembryos, die in einem Medium kultiviert wurden, das mit Teratokarzinom-Stammzellen konditioniert wurde.“ Verfahren der National Academy of Sciences 78,12 ( 1981): 7634-7638.Martin, Gail R. „Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells“. Verfahren der National Academy of Sciences 78,12 (1981): 7634-7638.
- Takahashi K, Yamanaka S (August 2006). „Induktion pluripotenter Stammzellen aus embryonalen und adulten Fibroblastenkulturen von Mäusen durch definierte Faktoren“. Zelle. 126 (4): 663–76.Takahashi K, Yamanaka S (August 2006). „Induktion von pluripotenten Stammzellen aus embryonalen und adulten Fibroblastenkulturen von Mäusen durch definierte Faktoren“. Zelle 126 (4): 663–76.
- Eiraku, Mototsugu, et al. „Selbstorganisierte Bildung von polarisierten kortikalen Geweben aus ESCs und deren aktive Manipulation durch extrinsische Signale.“ Zellstammzelle 3,5 ( 2008): 519-532.Eiraku, Mototsugu, et al. „Selbstorganisierte Bildung polarisierter kortikaler Gewebe aus ESCs und deren aktive Manipulation durch extrinsische Signale.“ Zellstammzelle 3,5 (2008): 519-532.
- Sato, Toshiro, et al. „Einzelne Lgr5-Stammzellen bauen in vitro Krypten-Villus-Strukturen ohne mesenchymale Nische auf.“ Natur 459,7244 ( 2009): 262-265.Sato, Toshiro, et al. „Einzelne Lgr5-Stammzellen bauen in vitro Krypten-Villus-Strukturen ohne mesenchymale Nische auf.“ Natur 459,7244 (2009): 262-265.
- Yui, Shiro, et al. „Das funktionelle Engraftment des Kolonepithels expandierte in vitro aus einer einzelnen adulten Lgr5+-Stammzelle.“ Naturmedizin 18,4 ( 2012): 618-623.Yui, Shiro, et al. „Das funktionelle Engraftment des Kolonepithels expandierte in vitro aus einer einzigen adulten Lgr5+-Stammzelle.“ Naturmedizin 18,4 (2012): 618-623.
- Unbekandt, Mathieu und Jamie A. Davies. „Die Dissoziation embryonaler Nieren, gefolgt von einer Reaggregation, ermöglicht die Bildung von Nierengewebe.“ Niere international 77,5 ( 2010): 407-416.Unbekandt, Mathieu und Jamie A. Davies. „Die Dissoziation embryonaler Nieren gefolgt von einer Reaggregation ermöglicht die Bildung von Nierengewebe.“ Nieren international 77,5 (2010): 407-416.
- Lancaster, Madeline A., et al. „Hirnorganoide modellieren die Entwicklung des menschlichen Gehirns und die Mikrozephalie.“ Natur 501,7467 ( 2013): 373-379.Lancaster, Madeline A., et al. „Zerebrale Organoide modellieren die Entwicklung des menschlichen Gehirns und die Mikrozephalie.“ Natur 501,7467 (2013): 373-379.
- Lee, Joo-Hyeon, et al. „Lungenstammzelldifferenzierung bei Mäusen, die von Endothelzellen über eine BMP4-NFATc1-thrombospondin-1-Achse gesteuert werden.“ Zelle 156,3 ( 2014): 440-455.Lee, Joo-Hyeon, et al. „Lungenstammzelldifferenzierung bei Mäusen, die von Endothelzellen über eine BMP4-NFATc1-thrombospondin-1-Achse gesteuert werden.“ Zelle 156,3 (2014): 440-455.
- Huch, Meritxell, et al. „In-vitro-Expansion einzelner Lgr5+-Leberstammzellen, die durch Wnt-gesteuerte Regeneration induziert werden.“ Natur 494,7436 ( 2013): 247-250.Huch, Meritxell, et al. „In-vitro-Expansion einzelner Lgr5+-Leberstammzellen, die durch Wnt-gesteuerte Regeneration induziert werden.“ Natur 494,7436 (2013): 247-250.
- Greggio, Chiara, et al. „Künstliche dreidimensionale Nischen dekonstruieren die Pankreasentwicklung in vitro.“ Entwicklung 140,21 ( 2013): 4452-4462.Greggio, Chiara, et al. „Künstliche dreidimensionale Nischen dekonstruieren die Pankreasentwicklung in vitro.“ Entwicklung 140,21 (2013): 4452-4462.