Überblick TRF / TR-FRET (HTFR)
Zeitaufgelöste Fluoreszenz (TRF)
Messungen der Fluoreszenzintensität (FI) nutzen Standard-Fluorophore wie Fluorescein, deren Emission kurzlebig, im Bereich von Nanosekunden, ist. Die Anregung der Probe und die Messung der Emission finden gleichzeitig statt. Obwohl Mikroplatten-Reader sehr gut darin sind, das für die Anregung eingesetzte Licht aus der Emissionsmessung herauszufiltern, trägt dieses Anregungslicht zusammen mit kurzlebigem Licht, das von Materialien in der Vertiefung oder der Probe emittiert wird, oft zu einem starken Hintergrund bei.
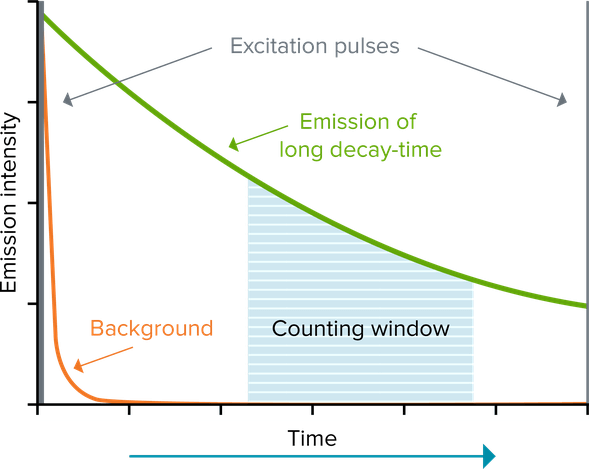
Die zeitaufgelöste Fluoreszenz (time-resolved fluorescence, TRF) verringert den Hintergrund, indem ein Lanthanoid-Fluorophor wie Europium oder Terbium genutzt wird, das eine langlebige Fluoreszenz emittiert. Diese langlebige Fluoreszenz hält über Millisekunden hinweg an. So ermöglicht die Anregung des Fluorophors durch eine Puls-Lichtquelle (z. B. eine Blitzlampe), gefolgt von einer Verzögerung und anschließender Signalmessung („Messfenster“), dass die kurzlebige Fluoreszenz (die nur Nanosekunden andauert) abklingen kann, bevor eine Messung durchgeführt wird. Assays, die die zeitaufgelöste Fluoreszenz anwenden, bieten eine deutliche Verbesserung des Signal-Rausch-Verhältnisses. Die am häufigsten verwendeten Lanthanoide sind Europium, Terbium und Samarium. Diese werden üblicherweise in Form von Chelat- oder Kryptatkomplexen eingesetzt, die eine gute Signalintensität und -stabilität ermöglichen.
Zeitaufgelöster Fluoreszenz-Resonanzenergiertransfer (TR-FRET)

kein FRET FRET
Donor und Akzeptor sind voneinander entfernt; Donor und Akzeptor sind in unmittelbarer Nähe zueinander
Die TR-FRET kombiniert zeitaufgelöste (time-resolved, TR)-Messungen der Fluoreszenz mit der Technologie des Fluoreszenz-Energieresonanztransfers (FRET). In FRET-Assays werden Biomoleküle (z. B. Proteine) mit Donor- und Akzeptorfluorophoren markiert. Wenn die Biomoleküle interagieren, werden die Donor- und Akzeptorfluorophore in unmittelbare Nähe zueinander gebracht. Wenn der Donor jetzt angeregt wird, kann er seine Emissionsenergie auf den Akzeptor übertragen, der wiederum Fluoreszenz einer spezifischen Wellenlänge emittiert. Die Fluoreszenzemissionen des Donors und des Akzeptors besitzen unterschiedliche Wellenlängen, die ein Mikroplatten-Reader voneinander unterscheiden kann. Dadurch wird eine Quantifizierung der biomolekularen Interaktion möglich.
Indem TR-FRET-Assays Lanthanoid-Fluorophore als Donatoren verwenden, die eine langlebige Fluoreszenzemission aufweisen, nutzen Sie die Vorteile zeitaufgelöster Fluoreszenzmessungen, um die kurzlebige Hintergrundfluoreszenz zu beseitigen. Dank der langlebigen Emission der Donorfluorophore kann in einem TR-FRET die Anregung und Emission sowohl der Donor- als auch der Akzeptorfluorophore auch dann noch gemessen werden, nachdem die kurzlebige Hintergrundfluoreszenz abgeklungen ist.
Homogene zeitaufgelöste Fluoreszenz (HTRF)
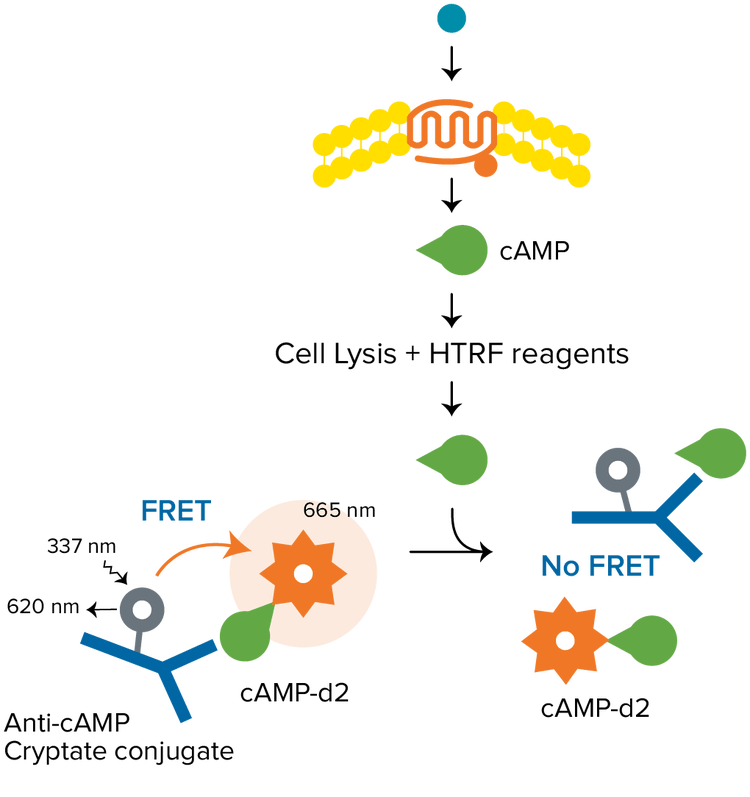
Die homogene zeitaufgelöste Fluoreszenz (homogeneous time-resolved fluorescence, HTRF) ist eine vielseitige Technologie, die von Cisbio zum Nachweis biomolekularer Interaktionen entwickelt wurde. Ein typischer HTRF-Assay verwendet ein Europiumkryptat als einen Donor und das organische Fluorophor d2 als einen Akzeptor. Donor und Akzeptor können eingesetzt werden, um eine Vielfalt von Biomolekülen für Anwendungen zu markieren, die die Epigenetik, Quantifizierung von Biomarkern, GPCR-Signaltransduktion und vieles mehr umfassen. HTRF-Assays benötigen einen Mikroplatten-Reader mit TRF-Detektionsmodus, der durch Cisbio als HTRF-kompatibel zertifiziert ist.
Vorteile und Überlegungen
Ein Hauptvorteil der TRF- und TR-FRET-Detektion schließt, im Vergleich zur Standard-Fluoreszenz, einen verringerten Hintergrund und ein erhöhtes Signal-Rausch-Verhältnis mit ein, was zu einer höheren Empfindlichkeit führt. Zusätzlich bietet der Assay ein robustes Mix-and-Read-Format, das keinerlei Waschschritte erfordert. Zusammen mit der Stabilität des Assays ermöglicht dies die Automatisierung und Miniaturisierung von Screeninganwendungen.
Anwendungen und Assays
TRF und TR-FRET (HTRF) Assays ermöglichen die Analyse molekularer Interaktionen in biochemischen Prozessen und werden weit verbreitet angewendet, um Kinaseassays, zelluläre Signalwege, Protein-Protein-Interaktionen, DNA-Protein-Interaktionen, die Zellzytotoxizität und Rezeptor-Liganden-Bindungen zu untersuchen.
Beispiele für TR-FRET-Assays sind in der Tabelle rechts aufgeführt, zusammen mit einigen weiter unten aufgeführten Ressourcen für die zeitaufgelöste Fluoreszenz.