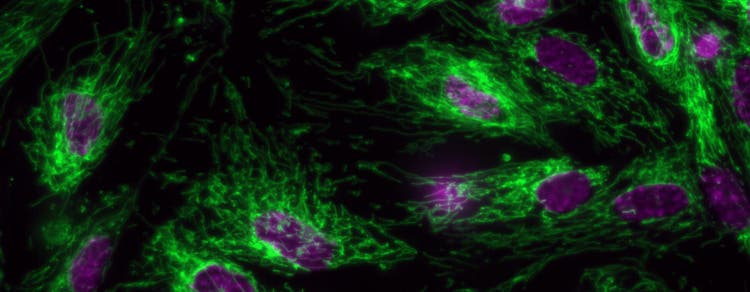
Fluoreszenz
Was ist Fluoreszenz?
Fluoreszenz bezeichnet die Fähigkeit mancher Atome und Moleküle, Licht bei einer bestimmten Wellenlänge (der Anregung: Ex, excitation) zu absorbieren und anschließend bei einer kurzlebigen Emission (Em) von Licht einer längeren Wellenlänge wieder abzugeben (Abbildung 2). Die Distanz zwischen den Anregungs- und Emissions-Peaks wird als Stokes-Verschiebung bezeichnet und ist abhängig vom Fluorophor (Abbildung 1).
Fluoreszenz erfordert eine externe Lichtquelle, um die Probe bei einer bestimmten Wellenlänge anzuregen. Wenn es bei der richtigen Wellenlänge angeregt wurde, wird das Molekül von einem Grundzustand in einen angeregten Zustand umgewandelt. Wenn das Molekül in den Grundzustand zurückfällt, wird die Energie in Form von Hitze (Energieverlust) und Licht bei einer längeren Wellenlänge geringerer Energie abgegeben (Abbildung 3).
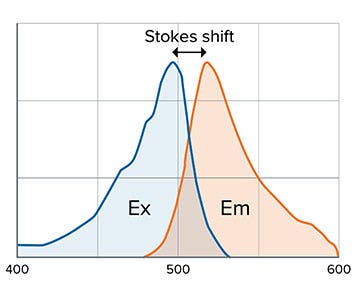
Abbildung 1
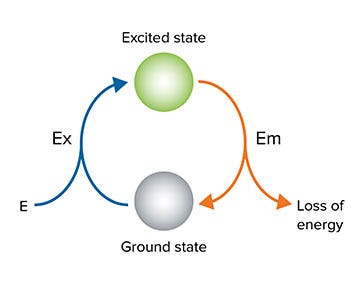
Abbildung 2
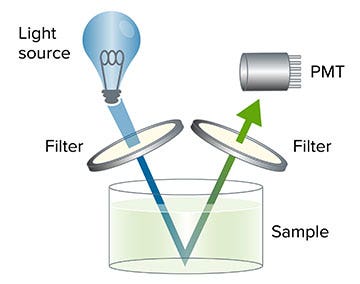
Abbildung 3
Wie funktioniert die Fluoreszenzdetektion?
Ein Mikroplatten-Reader mit Fluoreszenzintensitäts (FI)-Detektion nutzt eine Lichtquelle, üblicherweise eine Xenon-Blitzlampe oder LED, um ein Fluorophor (Fluoreszenzmolekül) bei einer bestimmten Wellenlänge anzuregen. Die für die Anregung der Probe erforderliche Wellenlänge kann entweder durch einen Filter einer bestimmten Wellenlänge oder einem Monochromator, der auf die erforderliche Wellenlänge eingestellt ist, isoliert werden.
Das Fluorophor emittiert dann Licht einer anderen Wellenlänge, das durch einen zweiten Filter oder Monochromator isoliert wird. Diese emittierte Fluoreszenz wird durch eine Photomultiplier-Röhre (PMT, photomultiplier tube) detektiert, und die Fluoreszenzintensität der Probe wird als relative Fluoreszenz ausgegeben.