
Wie 3D-Zellmodelle die Zukunft der Wirkstoffforschung prägen werden
Um die Wirksamkeit und toxische Effekte von Wirkstoffkandidaten zu entschlüsseln, verlässt man sich bei der Identifizierung von Zielmolekülen und bei der Wirkstoffentwicklung stark auf 2D-Zellmodelle und Tiermodelle. Dennoch gelingt es 90% der Kandidaten nicht, klinische Phase-III-Studien zu bestehen (1). Dies ist oft auf Komplikationen zurückzuführen, die präklinische Modelle nicht erfassen konnten. Die Aktualisierung dieser Modelle kann das Risiko eines klinischen Versagens umgehen und potenzielle Verzögerungen oder die Beendigung von Wirkstoffentwicklungsprojekten verhindern. Der Ersatz von 2D-Zellmodellen durch selbstorganisierende 3D-Modelle ist ein Schritt auf diesem Weg zu diesem Ziel. Dies ist jedoch kein einfacher Prozess und bringt so viele Herausforderungen mit sich wie zusätzliche Vorteile.
Die Prüfung des Wirkstoffziels diskutiert die Vergangenheit, Gegenwart und Zukunft von 3D-Zellmodellen mit Kenneth Pryde, Associate Director of Oncology Safety Sciences bei AstraZeneca, Florian Fuchs, Chief Technology Officer bei HeartBeat.bio, und Shan Dhamija, Vice President of Strategy and Innovation bei Molecular Devices.
https://share.vidyard.com/watch/kfyFLgxVTWuQbgiTnZN2x4
In dieser Diskussionsrunde diskutieren führende Experten aus der Branche das Versprechen der 3D-Biologie und Organoide für die Weiterentwicklung der Wirkstoffforschung. Sie untersuchen, wie Herausforderungen in der 3D-Biologie gelöst werden können und wie die Zukunft der Organoidforschung aussehen wird.
Sind 2D-Zellkulturen und Tiermodelle während der Wirkstoffentwicklung ideal?
Tiermodelle werden in der Humanbiologie und Wirkstoffentwicklung weit verbreitet eingesetzt. Aus regulatorischer und Sicherheitsperspektive ist es notwendig, dass ein Wirkstoffmolekül vor klinischen Phase-I-Studien präklinische Tierversuche durchläuft. Diese präklinischen Beobachtungen haben sich jedoch aufgrund der begrenzten Beurteilung der Pharmakokinetik und Pharmakodynamik bei Tieren im Vergleich zu Menschen nicht immer auf die klinische Leistungsfähigkeit übertragen. Dr. Pryde betont die Notwendigkeit von In-vitro-Modellen: „Zusätzliche In-vitro-Modelle sind erforderlich, um diese Tiermodelle zu ergänzen, um das Risiko von in der Klinik auftretenden Fluktuations- und Sicherheitsproblemen zu verringern, die die Tiermodelle nicht identifizieren konnten.“
Obwohl zelluläre 2D-Modelle Tierstudien ergänzen und die Genauigkeit präklinischer Bewertungen verbessern, zeigen sich deren Einschränkungen durch immer komplexere Krankheitsmodelle und gezielte Wirkstoffforschung. Herkömmliche 2D-Zellmodelle und entsprechende Assays rekapitulieren physiologische Ereignisse wie Zell-Zell-Kommunikation, Zell-extrazelluläre Matrix-Interaktionen (ECM) und physikalische Einschränkungen nicht. Laut Herrn Dhamija ist der Fokus auf neue Technologien unverhältnismäßig: „Während neue Werkzeuge eine präzise und nuancierte Entdeckung bei größerer biologischer Tiefe ermöglichen, wenn wir die Modellsysteme nicht ändern, werden wir nur noch besser darin sein, die falschen Antworten zu finden.“
Wie haben 3D-Zellmodelle Vorrang gegenüber 2D-Zellmodellen?
Einer der Hauptgründe, warum 3D-Zellmodelle sich von anderen abheben, ist, dass sie im Gegensatz zu 2D-Zellmodellen die In-vivo-Umgebung besser darstellen und sie somit prädiktiver für die potenziellen Auswirkungen einer Verbindung machen können. Dies hilft ihnen auch, in toxikologischen Studien bessere Leistungen zu erbringen, da sie potenzielle Risiken präklinisch vorhersagen können. Aus dieser Perspektive verringern 3D-Zellmodelle die Risiken, die mit falsch negativen oder positiven Ergebnissen in Tierstudien verbunden sind.
Da Tiermodelle in der Wirkstoffentwicklung und -prüfung immer noch unverzichtbar sind, können 3D-Zellmodelle auch verwendet werden, um ihre Relevanz für die menschliche Physiologie zu bewerten. Zellmodelle, die verschiedene tierische Gewebe repräsentieren, können helfen, die Korrelation zwischen der zellulären Dynamik von Tieren und Menschen aufzuklären, die sich auf immunogene Reaktionen und funktionelle Veränderungen auswirkt. Die Kombination von Modelltypen führt zu einer systemischeren Ansicht des untersuchten Gewebes oder Organs und minimiert gleichzeitig das Risiko einer Datenfehlinterpretation.
Verschiedene Arten von 3D-Zellmodellen und deren Vorteile
Wir können 3D-Zellmodelle in vier Hauptgruppen kategorisieren: Sphäroide, 3D-Bioprint-Modelle, Organoide und Organ-on-a-Chip. Sphäroide bestehen aus einer Gruppe von Zellen, die zu Kugeln koalesziert sind. 3D-Bioprint-Modelle sind ein Schritt darüber, da sie neben den Zellen auch räumliche Komplexität oder extrazelluläre Matrizen einführen. Organoide sind winzige, selbstorganisierte dreidimensionale Gewebekulturen, die aus Stammzellen gewonnen werden. Die letzte Kategorie ist Organ-on-a-Chip, das Mikrofluidik implementiert, um die Zirkulation, mechanische Stressoren und die Auswirkungen der Interaktionen zwischen verschiedenen Geweben zu simulieren.
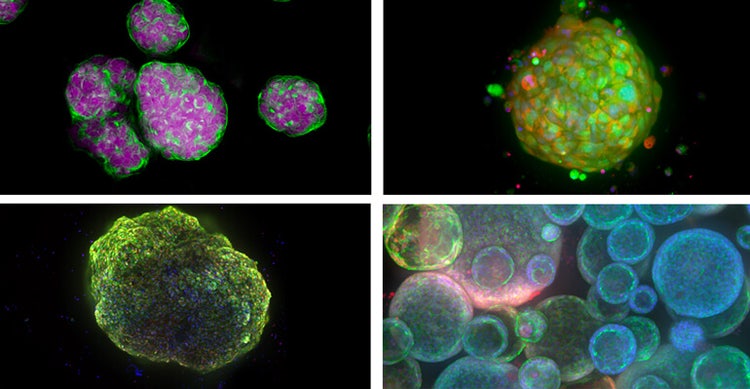
Beispiele für 3D-Zellmodelle von oben links – Sphäroide, von Patienten stammende Organoide (oder Tumoroide), kardioide (Herzorganoide) und Lungenorganoide.
Jede Art von 3D-Modell hat ihre eigenen Vor- und Nachteile. Organoide werden jedoch aus einer Reihe von Gründen weit verbreitet verwendet. Dr. Fuchs bevorzugt Organoide gegenüber anderen 3D-Modellen, da „sie über intrinsische Fähigkeiten zur Amplifikation verfügen und die Modellierung aller Entwicklungsschritte in einem Gewebe ermöglichen“. Er erkennt jedoch die Einschränkungen an, wie z. B. das Fehlen einer immunogenen Komponente. Ein weiteres Highlight von Organoiden und Sphäroiden, wie von Dr. Pryde hervorgehoben, ist ihre Skalierbarkeit und ihre Hochdurchsatzfähigkeit, da beide für 384-Well-Platten machbar sind. Dies ermöglicht es ihnen, regelmäßig im High-Throughput-Drogenscreening für Wirksamkeits- und Toxikologiestudien eingesetzt zu werden.
Einer der Hauptvorteile von Organoiden ist ihre Vielseitigkeit. Man kann das Organoid-Design mit einem riesigen Repertoire an Werkzeugen anpassen, um eine bestimmte Funktion zu rendern. Pluripotente Stammzellen sind die Hauptquelle in Organoidstudien, da sie sich direkt in gewebespezifische Zellen differenzieren können. Dies macht es biologisch relevanter und besser, die Zelltypen und die extrazelluläre Matrix nachzubilden. Darüber hinaus ermöglicht die Tatsache, dass diese genetisch verändert werden können, tiefere Einblicke in die Erforschung von Krankheitsmechanismen, Wirkstoffwirkung, Wirkstoffresistenz und Toxikologie.

Die Organ-on-a-Chip-Technologie von Mimeta, OrganoPlate®
Die Zukunft der Organoidforschung
Das Aufkommen biologisch relevanter Organoide und technologischer Verfeinerungen in Organoid-Arbeitsabläufen schaffen Raum für spannende Forschungsmöglichkeiten. Dr. Fuchs betont die mögliche Verwendung synthetischer Embryos zur Nachahmung der Embryoentwicklung, die ein besseres Verständnis der menschlichen Entwicklung fördern könnte. Er geht auch auf die Notwendigkeit ein, zu einer vollständig tierfreien präklinischen Testroutine überzugehen, und fordert die Regulierungsbehörden auf, ihre Kriterien neu anzupassen. „Tieremodelle sind möglicherweise nicht einmal für die Prüfung von Biologika nützlich, wie z. B. Impfstoffe gegen Antikörper, die so humanisiert sind, dass sie in Tiermodellen schwach immunogen sind. Es macht für uns also keinen Sinn, Tiere zu verwenden, wenn wir wissen, dass wir die Auswirkungen des Therapeutikums nicht beobachten werden.“
Dr. Pryde geht davon aus, dass die Organoidforschung immens zur personalisierten Medizin beitragen kann. „3D-Modelle schaffen diese neue Möglichkeit im therapeutischen Bereich des Zugangs zu biologischem Material von Patienten, um eine potenzielle Arzneimittelempfindlichkeit oder -resistenz zu identifizieren. Die Ergebnisse dieser Analyse können Ärzten helfen, zu entscheiden, ob ein bestimmtes Medikament für einen Patienten von Nutzen und geeignet ist oder nicht.“
Laut Herrn Dhamija wird maschinelles Lernen wahrscheinlich zu einem integraleren Bestandteil von 3D-Modellen werden, insbesondere bei der Enteisenung von Modellsystemen. „Während in der Wissenschaft der Anreiz darin besteht, eine höhere Komplexität zu verfolgen, ist die Erstellung robuster Forschungsprotokolle für 3D-Modelle für die Branche genauso wichtig. Mit maschinellem Lernen können neuartige Modelle reproduzierbarer, skalierbarer und konsistenter gestaltet werden, was das Risiko von Datendiskrepanzen verringert, die zu erheblichen Verzögerungen bei der Markteinführung und bei der Lieferung an Patienten führen würden.“
Dennoch hat die Organoidforschung einen langen Weg zur Perfektion. Eine der Herausforderungen besteht natürlich darin, Zugang zu großen Patientenproben zu erhalten oder eine ausreichende Anzahl an Stammzellspendern zu finden. Derzeit lassen sich Arzneimittelscreening- und Toxikologiestudien aufgrund der Variabilität der Patienten nicht in klinische Studien übersetzen. Aus diesem Grund muss der Zugang zu patientengeneriertem Material erweitert werden, um diese Variationen in präklinischen Umgebungen zu berücksichtigen. Um die Glaubwürdigkeit von Vorhersagen zu verbessern, können Forscher zudem In-vitro-Modelle mit computergestützten Modellen ergänzen, was auch einen ganzheitlicheren Überblick über die zu untersuchende Krankheit bietet.
- Mullard, Ascher. „Verschiedene klinische Erfolgsraten.“ Nature Reviews Drug Discovery 15,7 ( 2016): 447–448.
* Ende *
Werfen Sie einen Blick darauf, wo unsere Forschung stattfindet!
Besichtigen Sie unser Organoid Innovation Center, in dem wir modernste Instrumente präsentieren, die harmonisch zusammenarbeiten, um das Wachstum und die Überwachung von 2D- und 3D-Lebendzellkulturen mit intelligentem labelfreiem Imaging zu ermöglichen. Dieser integrierte Arbeitsablauf bietet Qualitätskontrollwarnungen und -bereitschaft, 3D-Organoid-Screening und Deep-Learning-Bildanalyse, die verborgene Muster aufdecken, die andere Technologien verpassen.