7 Tipps zur Optimierung Ihrer Arbeitsabläufe für das 3D-Zellimaging und dessen Analyse
Im Zuge der zunehmenden Komplexität von Assays bieten 3D-Zellsysteme im Vergleich zu herkömmlichen 2D-Assays für die Wirkstoffforschung und das Krankheitsmodell nachweislich physiologisch relevantere Informationen. In herkömmlichen 2D-Systemen dehnen, haften und wachsen Zellen auf einer flachen Oberfläche, während 3D-Systeme die In-vivo-Gewebeumgebung durch Zell-Zell-/ECM-Interaktionen, die Penetration von Verbindungen und die Dosisreaktion besser nachahmen.
Die zunehmende Komplexität von 3D-Assays bringt neue Herausforderungen im Zusammenhang mit dem zellulären Imaging mit sich, wie z. B. längere Bilderfassungs- und Analysezeiten sowie erhöhte Anforderungen an die Datenspeicherung. Mit den richtigen Werkzeugen und Techniken können Sie diese Herausforderungen meistern und zuverlässigere Daten auf effizientere Weise erhalten.
Hier sind sieben Tipps zur Optimierung Ihres Arbeitsablaufs für das 3D-Zell-Imaging und die -Analyse.
1. Verwenden Sie die richtigen Instrumente und Technologien für das Imaging von 3D-Zellkulturen
Bei der Arbeit mit 3D-Zellkulturen ist es nicht ausreichend, ein Bild einer Zellebene aufzunehmen, wie in herkömmlichen 2D-Zellkulturen. Stattdessen müssen Sie eine Reihe von Bildern in vertikalen Ebenen aufnehmen (üblicherweise 10-15 Bilder), die als Z-Stapel bezeichnet werden. Automatisierte konfokale Imaging-Plattformen wie das ImageXpress® Micro Confocal High-Content Imaging System ermöglichen es Ihnen, einen dünneren optischen Abschnitt der 3D-Struktur abzubilden und die Hintergrundtrübung erheblich zu reduzieren, was zu einer besseren Bildauflösung und feineren zellulären Details führt. Die Wasserimmersionsobjektive des ImageXpress Systems spielen ebenfalls eine Schlüsselrolle bei der Verbesserung der Bildqualität.
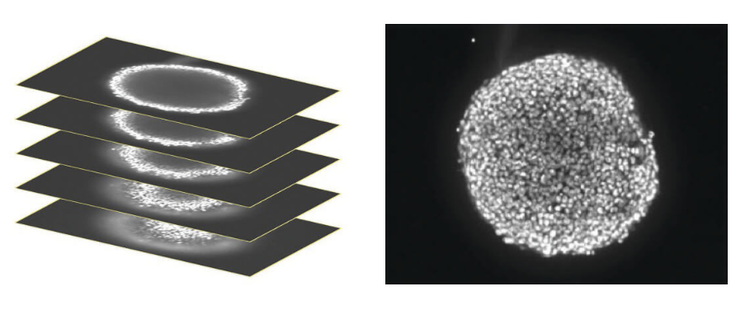
In der Z-Ebene wurde ein Stapel konfokaler Bilder aufgenommen, der ungefähr die Hälfte der Tiefe des Sphäroids (links) umfasste. Nur einige Zellen des Sphäroids befinden sich auf einer bestimmten Ebene im Fokus, sodass die Bilder zur Vereinfachung der Analyse in ein einziges 2D-Bild eingestürzt wurden, um die In-Fokus-Bereiche (rechts) zu kombinieren.
2. Verwenden Sie Mikroplatten, die speziell für das 3D-Imaging entwickelt wurden
Es ist wichtig, Mikroplatten zu verwenden, die speziell für das 3D-Imaging entwickelt wurden. Normalerweise handelt es sich hierbei um 96- oder 384-Well-Platten mit transparentem Boden. Die runden U-Boden-Platten von Corning eignen sich für die Herstellung von Sphäroiden und eignen sich ideal für das 3D-Imaging. Mit diesen Platten können Sie den Sphäroid während der Bildaufnahme zentriert und an Ort und Stelle halten. Flachbodenplatten dagegen sind problematisch, da sie die Zentrierung der Probe erschweren.
3. Befolgen Sie vor dem Imaging die richtigen Zellvorbereitungstechniken
Es ist wichtig, die Art der von Ihnen verwendeten 3D-Probe zu berücksichtigen, da verschiedene Proben unterschiedliche Vorbereitungs- und Imaging-Anforderungen haben. Beim Umgang mit festen Objekten, wie Sphäroide oder dicke Gewebeproben, gibt es einen begrenzten Abstand, den Sie aufgrund der begrenzten Lichtpenetration und Lichtstreuung, die zu einer Interferenz der Zellen führt, visualisieren können. Alternativ sind Zellen in Matrizen wie Matrigel transparent, sodass Sie das Objekt visualisieren und die Analyse mit einer größeren Lichtdurchdringung durchführen können.
Die Färbung zellulärer 3D-Objekte wie Sphäroide kann schwierig sein, da Farbstoffe nicht nur die Oberfläche, sondern auch das Innere der Probe durchdringen müssen. Im Falle des Hoechst-Farbstoffs, der für die Kernfärbung verwendet wird, müssen Sie möglicherweise eine 2X-3X höhere Konzentration verwenden, um eine effektive Penetration zu erzielen. Im Gegenzug müssen Sie möglicherweise eine längere Färbedauer einplanen. Typischerweise benötigt ein Farbstoff wie Hoechst 15-20 Minuten für die Färbung. Beim Umgang mit Sphäroiden müssen Sie jedoch möglicherweise 2bis3 Stunden für die Färbung einplanen. Einige Farbstoffe sind lipophil und können auf der Oberfläche haften bleiben, anstatt die Probe zu durchdringen. Die Färbung mit Antikörpern ist besonders schwierig, und Wissenschaftler arbeiten noch immer an der Entwicklung effektiver Färbeprotokolle.
4. Lokalisieren Sie die mittlere Position Ihrer 3D-Probe zu Beginn der Bilderfassung
Um den Imaging-Prozess zu starten, müssen Sie zunächst die Position des Objekts in der Mitte des Imaging-Standorts und den ersten Fokus finden, der sich ungefähr in der Mitte der Z-Position (vertikale Position) befinden würde. Wenn Sie beispielsweise ein Sphäroid mit einem Durchmesser von etwa 500 Mikrometern abbilden, liegt die Startposition etwa 50 Mikrometer über dem Wellboden. An dieser Startposition können Sie dann die Belichtung und die Versätze für verschiedene Kanäle anpassen.
Manchmal werden die Sphäroide außerhalb der Mitte, sodass Sie möglicherweise die Plattenabmessungen anpassen müssen, um sicherzustellen, dass die Sphäroide zentriert sind. Sie können auch die Platte an verschiedenen Ecken überprüfen, um sicherzustellen, dass die Sphäroide sichtbar sind.
5. Definieren Sie den Bereich Ihrer 3D-Bilderfassung von Anfang bis Ende
Dazu gehört die Aufnahme eines Stapels von Bildern in verschiedenen Tiefen innerhalb des Objekts und die genaue Definition, wo Sie beginnen müssen, wo Sie enden müssen, sowie die Definition der Anzahl der Schritte dazwischen. Üblicherweise können Sie bei einem 10X Objektiv mit einem Abstand von 8-10 μm zwischen den Schritten beginnen. Bei einem 20X-Objektiv würden Sie mit einem Abstand von 3-5 μm zwischen den Schritten usw. beginnen.
Obwohl die Erhöhung der Anzahl von Schritten die Qualität der Analyse und Visualisierung verbessert, kann eine übermäßige Anzahl von Bildern Ihre Aufnahme- und Analysezeit verlängern und die Datenspeicherung überlasten. Außerdem kann die Aufnahme zu vieler Bilder dazu führen, dass Ihre Probe verblasst. Letztendlich geht es darum, das richtige Gleichgewicht zu finden. Normalerweise verwende ich zwei verschiedene Protokolle für eine einzelne Platte. Einer nutzt einen größeren Abstand zwischen den Schichten und der andere weniger.
Es ist auch sehr wichtig, die Art des Projektionsbilds anzugeben, das Sie zu Beginn der Aufnahme aufnehmen möchten. Typischerweise wird für das konfokale Imaging das Objekt auf „maximales Projektionsbild“ eingestellt, wodurch automatisch viele Informationen über die Probe erzeugt werden. An dieser Stelle können Sie wählen, nur das Projektionsbild anstelle der 3D-Analyse zu analysieren, um den Prozess zu beschleunigen.
6. Verwenden Sie QuickID- und Wasserimmersionsobjektive, um Ihre Bildaufnahmezeit zu verkürzen
Während der Aufnahme können 3D-Objekte von der Mitte des Wells wegdriften, wodurch sie schwer zu finden sind. Dies gilt insbesondere für Sphäroide in Flachbodenplatten. Um diese Herausforderung zu meistern, verfügt unser ImageXpress Micro Confocal System über eine Funktion namens QuickID Targeted Image Acquisition . Das System nimmt Bilder bei geringer Vergrößerung auf, um das Objekt von Interesse zu finden, und nimmt dann das Objekt von Interesse automatisch in einem einzigen Sichtfeld bei höherer Vergrößerung auf. Dies reduziert die Aufnahmezeit und die Anforderungen an die Datenspeicherung erheblich. Die Verwendung von Wasserimmersionsobjektiven ist ebenfalls von Vorteil, da sie höhere Signale aus der 3D-Probe sammeln und Ihnen so ermöglichen, Ihre Expositionszeit zu verkürzen und die Aufnahmegeschwindigkeit zu erhöhen.
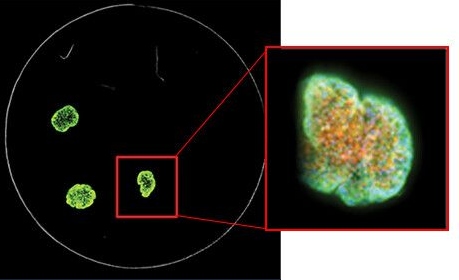

7. Verwenden Sie die entsprechende 3D-Analysesoftware
Unsere zellulären Imaging-Systeme umfassen die MetaXpress® High-Content Image Acquisition and Analysis Software , die viele Werkzeuge bietet, um die Analyse zu einem nahtloseren Prozess zu machen. Der einfachste Ansatz wäre, die In-Fokus-Bereiche Ihres Bildstapels mit dem Algorithmus für die maximale Projektion der Software in einer einzigen 2D-Projektion zu kombinieren. Sie können Werkzeuge für normale 2D-Analysen wie Zellkernzählung, Zellauswertung und Neuritenauswuchs verwenden.
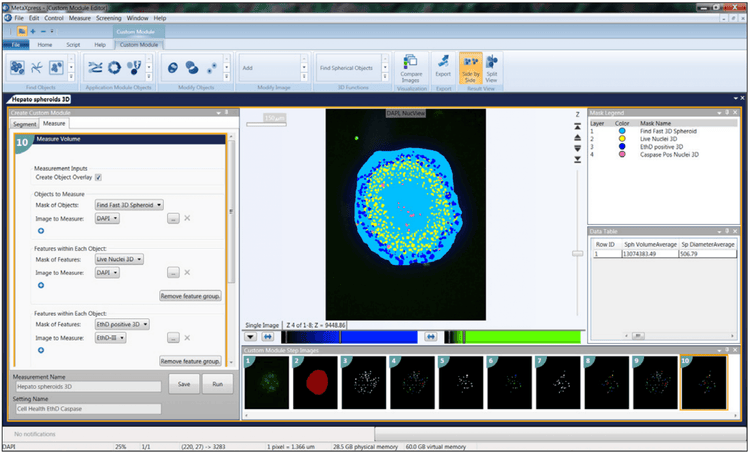
Für die 3D-Analyse können Sie in jedem Z-Stapel interessante Objekte finden und diese dann kombinieren. Wenn Sie beispielsweise mit Sphäroide oder Zellen in Matrigel arbeiten, können Sie mit dem Werkzeug „Runde Objekte suchen“ das Objekt in einem einzigen Schritt finden, sobald Sie die ungefähre Objektgröße und den Schwellenwert der Intensität definieren. Ein weiteres gebräuchliches Werkzeug ist „Connect by best match“. Hier wählen Sie Ihr Analyseprotokoll aus (z. B. Zellkerne zählen, Lebend/Tot oder Zellauswertung) und führen es separat für jeden Z-Schnitt aus. Der Algorithmus verbindet dann bestimmte Objekte zwischen benachbarten Z-Schichten in einem 3D-Volumen, basierend auf der maximalen Verschiebung von Objekten zwischen Schichten, die Sie als akzeptabel kennzeichnen. Sie können dann Ihre Objekte im 3D-Format visualisieren und, was noch wichtiger ist, Sie können eine volumetrische 3D-Analyse durchführen, um Volumen, Abstand zwischen Objekten usw. zu identifizieren.
Um mehr über die Optimierung Ihres Arbeitsablaufs im 3D-Zell-Imaging und -Analyse zu erfahren, besuchen Sie unsere Webseite für 3D-Zellmodelle.