
Western Blot
Was ist Western Blotting?
Western Blotting ist eine beliebte Technik, die zum Proteinnachweis und zur Proteinquantifizierung angewendet wird. Es ermöglicht die Abtrennung und Identifizierung eines bestimmten Proteins von Interesse aus einem komplexen Proteingemisch, zum Beispiel einem Zelllysat. Durch seine Anwendung in der Diagnostik, Biotechnologie, Molekularbiologie, Proteomik und vielem mehr wird weitverbreitet auf Western Blots vertraut, um die Stärke der Proteinexpression in Zellen zu bestimmen sowie Veränderungen in der Proteingröße und anderen Eigenschaften festzustellen.
Western Blot-Methoden
Es können mehrere Western Blot-Methoden in Betracht gezogen werden. Je nachdem welcher sekundäre Antikörper verwendet wird, kann der Nachweis des Zielproteins kolorimetrisch, chemilumineszent oder fluoreszent erfolgen. Diese Methoden werden unten beschrieben und erfordern unterschiedliche Laborausstattungen für den Nachweis. Chemilumineszenz kann zum Beispiel mithilfe eines Röntgenfilms oder mit Instrumenten für digitales Imaging nachgewiesen werden, während ein fluoreszenter sekundärer Antikörper einen Fluoreszenz-Imager erfordert. Jede Nachweisart hat Vorteile und Nachteile, die bei der Auswahl einer Methode berücksichtigt werden müssen.
Eine andere von uns vorgestellte Methode ist das ScanLater™ Western Blot Detection System. Als das erste seiner Art ermöglicht es die Western Blot-Detektion auf einer Multimodus-Mikroplatten-Reader-Plattform. Dieser substratfreie Assay bietet Forschern eine vergleichbare Empfindlichkeit wie herkömmliche Chemilumineszenz- und Fluoreszenz-Assays während er den Western Blot, den ELISA und andere Anwendungen in einem einzigen Reader vereinigt. Unsere unten aufgeführten Application Notes liefern weitere Details.
Arbeitsablauf eines Western Blotting-Assays
Dies hier sind die Schritte, die bei einem typischen Western Blot-Assay durchgeführt werden:
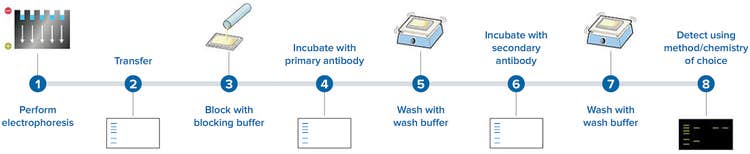
1. Durchführung der Elektrophorese – Die Proteine werden zuerst mittels Gelelektrophorese nach Größe aufgetrennt.
2. Transfer – Dann werden sie auf eine Blotting-Membran übertragen, die üblicherweise aus Nitrozellulose oder PVDF besteht und mit einem für das Protein von Interesse spezifischen primären Antikörper inkubiert wird.
3. Blockieren mit Blockierungspuffer – Dies verhindert die Bindung des primären Antikörpers (nächster Schritt) an die Membran selbst.
4. Inkubieren mit primärem Antikörper – Der primäre Antikörper bindet an das Zielprotein.
5. Waschen mit Waschpuffer – Ungebundener primärer Antikörper wird weggewaschen.
6. Inkubation mit sekundärem Antikörper – Ein sekundärer Antikörper, der den primären Antikörper erkennt und bindet, wird hinzugefügt. Dieser sekundäre Antikörper ist mit einem Enzym oder einem anderen Material konjugiert, was den Nachweis des Proteins von Interesse ermöglicht, das als Band auf dem Blot erscheint.
7. Waschen mit Waschpuffer – Ungebundener sekundärer Antikörper wird weggewaschen.
8. Nachweis durch die Methode/Chemie der Wahl – Das Zielprotein kann in Abhängigkeit vom eingesetzten sekundären Antikörper durch kolorimetrische, fluoreszente oder lumineszente Methoden nachgewiesen werden.
Überblick Western Blot
Western Blot-Methoden
Western Blot-Anwendungen
- Nachweis und Quantifizierung von Proteinen mit dem ScanLater Western Blot-Detektionssystem
- Validieren Sie CRISPR-editierte Zellen mittels Imaging und Western Blot-Nachweis
- Wells to Westerns: Untersuchung der zellulären Hitzeschockreaktion
- Abschätzung des Molekulargewichts von Proteinen mit der ScanLater Western Blot Protein Ladder
- Proteinnachweis basierend auf Europium-markierten Proteinen