
Zellzählsystem
Beim Zellzähler: MCF-7-Zellen
Da Oktober der „Breast Cancer Awareness Month“ ist, haben wir beschlossen, die MCF-7 Brustkrebszelllinie zu beleuchten. Die Zelllinie wurde im Jahr 1970 von einer Nonne mit dem Namen Sister Catherine Frances (Helen Marion) Mallon gewonnen und nach der Michigan Cancer Foundation benannt, bei der sie erzeugt wurde. MCF-7 ist eine der wenigen Brustkrebs-Zelllinien, die erhebliche Mengen des Östrogenrezeptors (ER, estrogen receptor) alpha exprimiert und Forschern als ein wertvolles Modellsystem zur Erforschung ER-positiver Brustkrebsarten dient. Geben Sie „MCF-7-Zellen“ in die PubMed ein und sie werden über 20.000 Referenzen zu dieser bemerkenswerten Zelllinie bekommen.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1: Abbildungen, die mit dem SpectraMax MiniMax Cytometer aufgenommen wurden
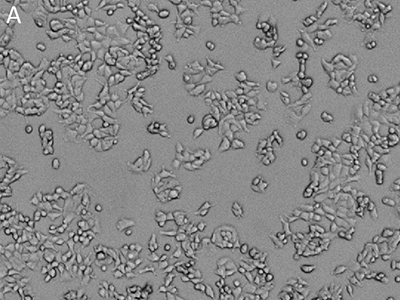
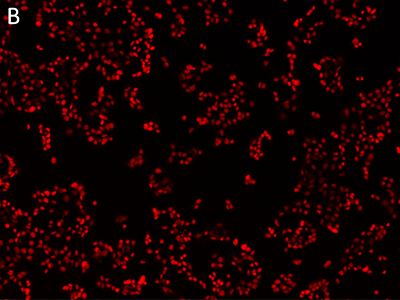

MCF-7-Zellen wurden mit der EarlyTox™ Live Red Dye gefärbt und dann mit dem SpectraMax MiniMax Cytometer aufgenommen. Die Identifizierung der Zellen erfolgte mit benutzerdefinierten Einstellungen. A: Durchlichtaufnahme, B: Zellkerne gefärbt mit der EarlyTox Live Red Dye, C: Zellen, die mit der StainFree-Analyse identifiziert wurden (violette Maske zeigt Zellen, die von der Software identifiziert wurden).
Abbildung 2: Zellzahlbestimmung mittels StainFree vs. Zellzahlbestimmung mittels Fluoreszenz
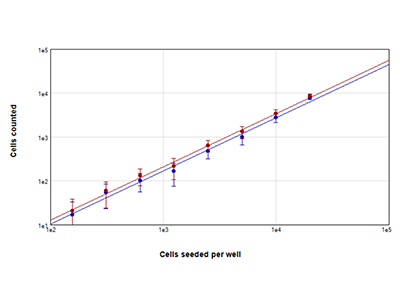
Die MCF-7-Zellen wurden bei einer Dichte von 156 bis 20.000 Zellen pro Well ausgesät und die Zellkerne wurden mit dem EarlyTox Live Red Farbstoff gefärbt. Pro Well wurden Bilder an 4 Positionen aufgenommen und in der Mitte des Wells wurde eine Region von Interesse für die Analyse ausgewählt. Anschließend wurde die Zellzahl entweder durch die Anwendung der StainFree-Methode (blauer Graph) oder das Auszählen rot fluoreszierender Nukleine (roter Graph) bestimmt.
Abbildung 3: EarlyTox Live/Dead Assay
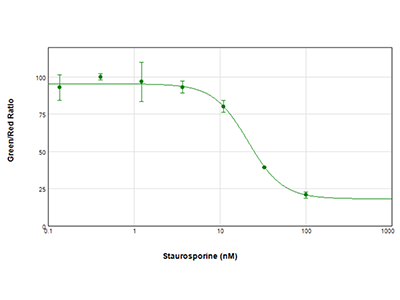
MCF-7-Zellen wurden für 24 Stunden mit seriellen Verdünnungen von Staurosporin behandelt und dann mit dem EarlyTox Live/Dead Assay Kit untersucht. Lebende Zellen wurden mit Calcein AM (grüner Farbstoff) und tote Zellen mit Ethidium Homodimer (roter Farbstoff) gefärbt. Die Platte wurde mit dem SpectraMax i3x Multi-Mode Microplate Reader gemessen. Die Ergebnisse wurden als Verhältnis von grün / rot gegen die Konzentration der Verbindung aufgetragen und ein IC50-Wert von 21,2 nM wurde mit der SoftMax Pro Software berechnet.
Tipp:
MCF-7-Zellen besitzen eine polygonale Morphologie mit unregelmäßigen Größen, und sie weisen die Angewohnheit auf, zu großen Aggregaten zu verklumpen. Für die Zellzahlbestimmung mit StainFree, gehen Sie in „Create New Setting“ und zeichnen Sie die Zellen mit dem gelben Zeichenwerkzeug knapp innerhalb der Zellränder nach. Verwenden Sie das blaue Zeichenwerkzeug, um Bereiche außerhalb der Zellränder zu markieren. Alternativ können Sie die vordefinierte Einstellung „CellsC“ verwenden, was jedoch nicht ganz genaue Begrenzungslinien ergeben wird.
MCF-7 Cells Analysis Toolkit
- SpectraMax ® i3x Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Durchlicht (TL, transmitted light)
713 nm (rote Fluoreszenz)
TL-Exposition: 7 ms
Anpassung Durchlicht (TL, transmitted light)-Fokus: -10 µm
713 Exposition: 6 ms
713 Fokusanpassung: 0 µm
Art der Analyse: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: TL (StainFree) oder 713 (rote Zellkerne)
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.