
Zellzählsystem
Beim Zellzähler: RBL-Zellen
Die Etablierung von Basophilenleukämie-Zelllinien aus der Ratte in den 1970er Jahren bot Forschern ein zwar unvollkommenes, aber komfortables Modellsystem für die Erforschung von Mastzellen, die schwierig zu gewinnen waren. RBL-2H3-Zellen, die aus einem der original RBL-Zelllinien subkloniert wurden, wurden für die Erforschung der biochemischen Signalwege der Sekretion in Mastzellen herangezogen. Manche RBL-Zelllinien werden in Suspensionskulturen gezogen und andere sind adhärent. Die Morphologie der Zellen kann unter verschiedenen Wachstumsbedingungen, oder sogar innerhalb ein und derselben Kultur, unterschiedlich sein. Daher ist es extrem hilfreich, dass die StainFree-Analyseeinstellungen es ermöglichen, benutzerdefinierte Einstellungen vorzunehmen, um genaue Zellzahlbestimmungen sicherzustellen!
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1: Zellzahlbestimmungen mit StainFree
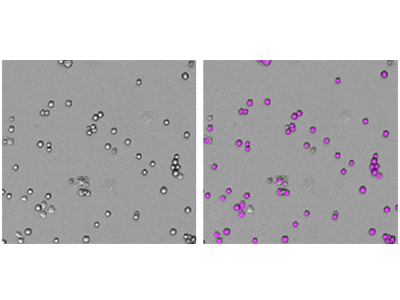
RBL-1-Zellen wurden mit dem SpectraMax i3 MiniMax 300 Imaging Cytometer aufgenommen und die Zellen wurden mit einer benutzerdefinierten Einstellung identifiziert. Auf der linken Seite ist das originale Durchlichtbild gezeigt. Auf der rechten Seite ist dasselbe Bild mit violetten Masken dargestellt, die die von der Software identifizierten Zellen kennzeichnen.
Abbildung 2: Bestimmung der Zellzahl mittels StainFree vs. Bestimmung der Anzahl an Zellkernen mittels Fluoreszenz
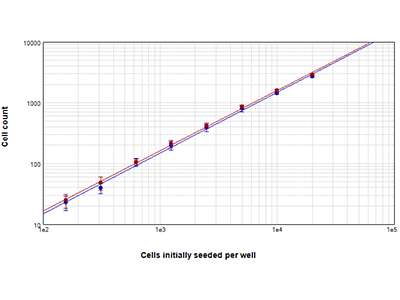
Bei Dichten von 156 bis zu 20.000 Zellen pro Well ausgesäte RBL-1-Zellen wurden mit der StainFree-Technologie (blaue Punkte) ausgezählt oder mit der EarlyTox™ Live Red Dye gefärbt und die rot fluoreszierenden Zellkerne ausgezählt (rote Punkte). Die mit beiden Methoden bestimmten Zellzahlen stimmen über alle Zelldichten hinweg nahezu überein. Die Zellzahlen wurden innerhalb einer vom Benutzer definierten Region von Interesse (ROI, region of interest) ausgezählt.
Abbildung 3: FLIPR Calcium 6 Assay auf dem FlexStation 3 Multi-Mode Microplate Reader
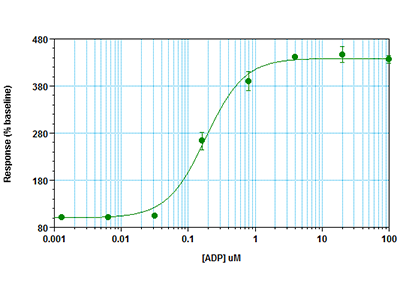
RBL-2H3-Zellen wurden mit 30.000 Zellen pro Well in einer 96-Well-Platte ausgesät und über Nacht inkubiert. Am nächsten Tag wurde das Wachstumsmedium entfernt und der Farbstoff des FLIPR® Calcium 6 Assays sowie Probenecid wurden zu den Wells hinzugegeben, bevor die Zellen für 2 Stunden inkubiert wurden. Anschließend wurde ein Fluoreszenz-Kinetik-Assay auf einem FlexStation® 3 Multi-Mode Microplate Reader durchgeführt. Der geräteeigene Pipettor fügte den Agonisten ADP zu den Wells hinzu, während gleichzeitig die Fluoreszenzsignale, die die Calcium-Mobilisierung anzeigen, vom Fluoreszenz-Reader von der Unterseite der Wells her gemessen wurden.
Abbildung 4: Fura-2 QBT Calcium Assay auf dem FlexStation 3Multimodus-Mikroplatten-Reader
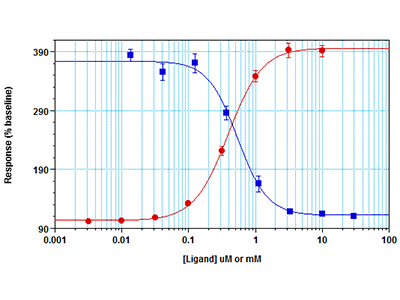
RBL-2H3-Zellen wurden mit 30.000 Zellen pro Well in einer 96-Well-Platte ausgesät und über Nacht inkubiert. Am nächsten Tag wurden sie nach dem Entfernen des Wachstumsmediums für 60 Minuten mit dem Fura-2 QBT™-Farbstoff beladen. Zur Bestimmung der IC50-Werte wurde der Inhibitor YM-58483 45 Minuten vor dem Assay zu den Zellen hinzugegeben. Anschließend wurde ein Fluoreszenz-Kinetik-Assay auf einem FlexStation 3 Multi-Mode Microplate Reader durchgeführt. Der geräteeigene Pipettor pipettierte CaCl2 zu den Wells hinzu, und zwar in der EC80-Konzentration (für inhibitor-Assays, blaue Punkte) oder in einer Titrationsreihe (rote Punkte). Gleichzeitig wurden die Fluoreszenzsignale, die die Calcium-Mobilisierung anzeigen, vom Fluoreszenz-Reader von der Unterseite der Wells her gemessen.
Tipp:
Da in Suspensionskulturen von RBL-Zellen oftmals adhärente Zellen anwesend sind, kann eine vom Benutzer in der SoftMax Pro Software definierte Analyseeinstellung sehr hilfreich dabei sein, dem Gerät „beizubringen“, nur die Zellen zu identifizieren, die eine typische Morphologie von Zellen in Suspension aufweisen, und die adhärenten Zellen auszuschließen. Für adhärente Kulturen, die unterschiedliche Zellmorphologien aufweisen können, maximiert eine vom Benutzer definierte Analyseeinstellung die Identifizierung der Zellen unabhängig von deren Form.
RBL Cells Analysis Toolkit
- SpectraMax ® i3 Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Instrumenten-Einstellungen für Imaging und Zellzahlbestimmung
Exposition: 7 ms
Fokusanpassung: 20 µm
Art der Analyse: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: TL
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.