
Zellzählsystem
Beim Zellzähler: NIH3T3-Zellen
Die im Jahr 1963 durch die Wissenschaftler George Todardo und Howard Green etablierte NIH3T3-Zelllinie wurde aus embryonalen Mausfibroblasten gewonnen. Die Zellen immortalisierten spontan und wurden nach dem zu ihrer Kultivierung verwendeten Protokoll „3-day transfer, inoculum 3x105 cells“ benannt. Heute dienen sie als Standard-Fibroblastenzelllinie und sind als außergewöhnlich guter Transfektionsempfänger und als Modell für induzierte Stammzell-Pluripotenz-Experimente bekannt. Zudem sind sie in der Stammzellforschung als Feeder-Zellen für humane embryonale Stammzellen hilfreich und werden oft für die Kultivierung von Keratinozyten eingesetzt, da die Wachstumsfaktoren aus den NIH3T3-Zellen für das Wachstum der Keratinozyten förderlich sind.
Die längliche Struktur und die variierende Zellgröße der NIH3T3-Zellen kann bei der Bildanalyse Schwierigkeiten verursachen. Die StainFree Technology versetzt uns jedoch in die Lage, diese unregelmäßig geformten Zellen mit großer Genauigkeit zu zählen.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1. StainFree-Analyse von NIH3T3-Zellen
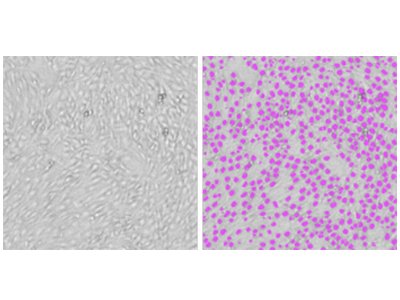
NIH3T3-Zellen wurden mit dem SpectraMax MiniMax 300 Imaging Cytometer aufgenommen und die Zellen wurden mit der vordefinierten Analyseeinstellung „CellsB“ identifiziert. Auf der linken Seite ist das originale Durchlichtbild gezeigt. Auf der rechten Seite ist dasselbe Bild mit violetten Masken dargestellt, die die von der Software identifizierten Zellen kennzeichnen.
Abbildung 2: Bestimmungen der Zellzahlen von NIH3T3-Zellen
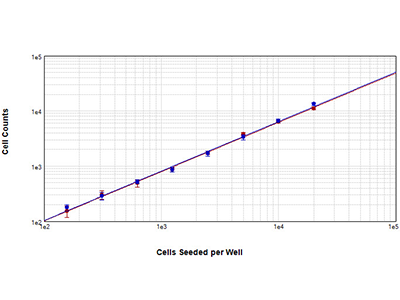
NIH3T3-Zellen wurden in einer 1:2-Verdünnungsserie in einer 96-Well-Platte ausplattiert. Die Zellen wurden fixiert und mit einem Zellkernfarbstoff gefärbt. Nach der Färbung wurde das SpectraMax MiniMax 300 Imaging Cytometer eingesetzt, um die Zellen entweder auf Basis der roten Zellkernfärbung (rote Kurve) oder auf Basis der StainFree™ Cell Detection Technology (blaue Kurven) zu identifizieren. Beide Methoden der Zellzahlbestimmung ergeben fast identische Ergebnisse und beide Kurven weisen einen R2 > 0.99 auf.
Abbildung 3. Gefärbte NIH3T3-Zellen
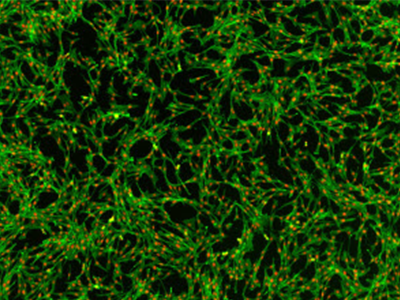
NIH3T3-Zellen, die mit AlexaFluor 488-Phalloidin und rotem Zellkernfarbstoff gefärbt wurden. Die Bilderfassung erfolgte auf dem SpectraMax MiniMax 300 Imaging Cytometer.
Tipp:
Für viele NIH3T3-Kulturen können Sie die Zellen einfach mit einer der in der SoftMax Pro Software vordefinierten Einstellungen zählen. Es kann entweder die „CellsB“- oder die „CellsD“-Einstellung angewendet werden. Alternativ können Sie die Zeichenwerkzeuge einsetzen, um eine neue benutzerdefinierte Einstellung für Ihre speziellen Zellen zu definieren. Um Probleme zu vermeiden, die durch die unregelmäßige Form der Zellen verursacht werden, können Sie knapp innerhalb der Grenzen der Zellen von Interesse zeichnen. Um ein Überzählen der Zellen zu vermeiden, das durch die langen Fortsätze dieser Zellen verursacht werden kann, zeichnen Sie ganz einfach mit dem Hintergrund-Werkzeug über die Zellfortsätze, so dass diese nicht mehr als separate Zellen erkannt und gezählt werden.
NIH3T3 Cells Analysis Toolkit
- SpectraMax® i3 Multi-Mode Microplate Detection Platform
- SpectraMax® MiniMax™ 300 Imaging Cytometer
- SoftMax® Pro Software
Instrumenteinstellungen
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.