
Zellzählsystem
Beim Zellzähler: Jurkat-Zellen
Nach der Gewinnung aus dem peripheren Blut eines kleinen Jungen mit T-Zell-Leukämie in den späten 1970er Jahren, wurden Jurkat-Zellen als eine immortalisierte T-Lymphozyten-Zelllinie etabliert. Sie werden eingesetzt, um die T-Zell-Leukämie, die T-Zell-Signaltransduktion und die Empfindlichkeit von Krebszellen gegenüber der Behandlung mit Wirkstoffen zu erforschen. Diese kleinen, runden Zellen wachsen bereitwillig in Suspension und wurden, wie hier gezeigt, auch als Modellsysteme für viele verschiedene Zellviabilitäts- und Apoptose-Assays verwendet.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1: Zellzahlbestimmungen mit StainFree

Jurkat-Zellen wurden mit dem SpectraMax MiniMax 300 Imaging Cytometer aufgenommen und die Zellen wurden mit der vordefinierten Analyseeinstellung „CellsC“ identifiziert. Auf der linken Seite sind die original Durchlichtbilder gezeigt. Auf der rechten Seite sind dieselben Bilder mit einer violetten Maske dargestellt, die die von der Software identifizierten Zellen hervorhebt. Es sind zwei Zelldichten gezeigt: 50.000 und 1562 Zellen pro Well, ausgesät auf einer 96-Well-Platte.
Abbildung 2: Zellzahlbestimmung mittels StainFree vs. Zellzahlbestimmung mittels Fluoreszenz
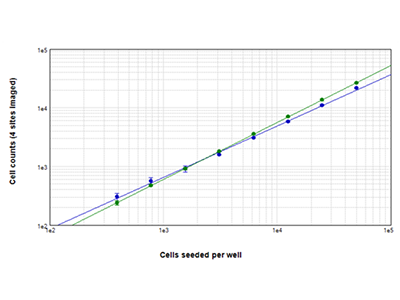
Jurkat-Zellen, die bei Zelldichten von 390 bis 50.000 Zellen pro Well ausgesät wurden, wurden mit der StainFree-Technologie (blaue Punkte) analysiert, oder sie wurden mit dem Farbstoff des EarlyTox™ Live Cell Assays gefärbt und die grün fluoreszierenden Zellen ausgezählt (grüne Punkte). Die mit beiden Methoden bestimmten Zellzahlen stimmen über alle Zelldichten hinweg nahezu überein. Die Zellzahlen wurden für vier Bereiche pro Well ausgezählt.
Abbildung 3: EarlyTox™ Live/Dead Assay
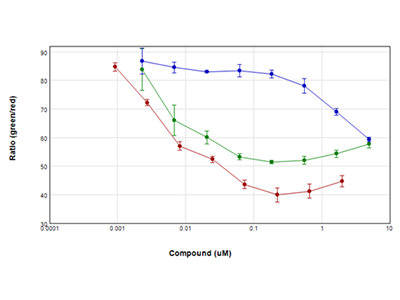
Jurkat-Zellen wurden für 24 Stunden mit seriellen Verdünnungen von Staurosporin (rote Punkte), Camptothecin (grüne Punkte) und Etoposid (blaue Punkte) behandelt und dann mit dem EarlyTox Live/Dead Assay-Kit von Molecular Devices untersucht. Lebende Zellen wurden mit Calcein AM (grüner Farbstoff) und tote Zellen mit Ethidium Homodimer (roter Farbstoff) gefärbt und auf einem SpectraMax i3x Multi-Mode Microplate Reader mit der „WellScan“-Funktion analysiert, die mehrere, gleichmäßig über das Well verteilte Messungen vornimmt. Die Ergebnisse wurden als Verhältnis von grün / rot gegen die Konzentration der Verbindung grafisch dargestellt. Alle in diesem Experiment eingesetzten Verbindungen bewirkten innerhalb von 24 Stunden eine dramatische Verringerung der Zellviabilität.
Abbildung 4: EarlyTox Caspase-3/7 NucView™ 488 Assay
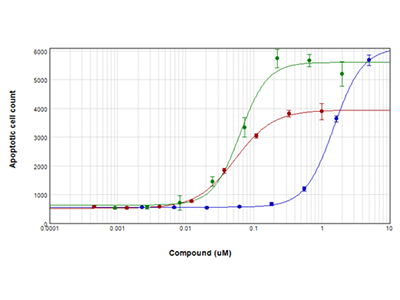
Jurkat-Zellen wurden für 28 Stunden mit seriellen Verdünnungen von Staurosporin (roter Graph), Camptothecin (grüner Graph) und Etoposid (blauer Graph) behandelt und dann mit dem EarlyTox Caspase-3/7 NucView 488 Assay-Kit untersucht. Caspase-3/7-exprimierende Zellen wurden grün fluoreszierend gefärbt und mit dem SpectraMax MiniMax 300 Imaging Cytometer aufgenommen und ausgezählt.
Tipp:
Dank ihrer abgerundeten Morphologie und einheitlichen Größe sind Jurkat-Zellen ziemlich einfach abzubilden und zu zählen. Für die Zellzahlbestimmung mit StainFree funktioniert die vordefinierte Einstellung „CellsC“ der SoftMax Pro Software hervorragend.
Jurkat Zellanalyse-Toolkit
- SpectraMax ® i3x Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Art der Analyse: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: TL
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.