
Zellzählsystem
Beim Zellzähler: HeLa-Zellen
HeLa- (Henrietta-Lacks)-Zellen sind die erste Zelllinie, die im Labor gezogen wurde und werden heute nach wie vor in unzähligen biomedizinischen Forschungsprojekten verwendet. Es sind Zellen aus einem Gebärmutterhalskrebs, die Henrietta Lacks im Jahr 1951 entnommen wurden, einer Patientin, die später an dieser Erkrankung verstarb. Der Bestseller von Rebecca Skloot „The Immortal Life of Henrietta Lacks“ erzählt die faszinierende Geschichte ihres Lebens und ihrer Hinterlassenschaft.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1. StainFree-Analyse im Vergleich zur Zellzahlbestimmung mittels Fluoreszenz
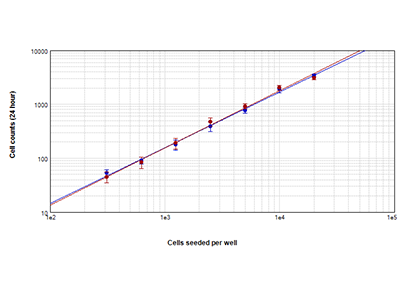
Zellen, die mit der StainFree™-Zellbestimmungs-Technologie (blaue Kreise) und roter Zellkernfärbung (rote Kreise) ausgezählt wurden. Die Zellzahlen aus beiden Methoden stimmen fast genau überein. Dies beweist, dass die StainFree-Technologie genaue Zellzahlbestimmungen liefert und gleichzeitig die Notwendigkeit für Fluoreszenzfarbstoffe beseitigt (r > 0,99 für jeden Graph).
Abbildung 2. Wachstumskurven, die aus StainFree-Analysen der zellbedeckten Bereiche erhalten wurden
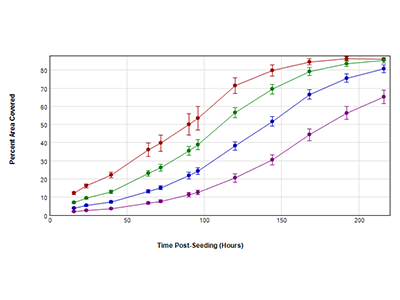
Die HeLa-Zellen wurden in 4 verschiedenen Ausgangsdichten in einer 96-Well-Platte ausgesät: 250 (violett), 500 (blau), 1000 (grün) und 2000 (rot) Zellen pro Well. Die Zellen wurden im Durchlicht (TL, transmitted light)-Kanal über 9 Tage aufgenommen. Der von Zellen bedeckte prozentuale Bereich wurde für jeden Zeitpunkt mittels StainFree-Analyse bestimmt.
Abbildung 3. Messung der Zytotoxizität mit der StainFree-Technologie.
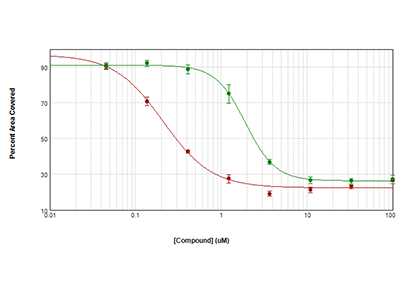
HeLa-Zellen wurden bei 1000 Zellen pro Well ausgesät und über Nacht wachsen gelassen. Dann wurden sie für 72 Stunden mit Anisomycin (rote Kreise) oder Trichostatin (grüne Kreise) behandelt. Die Bestimmung der Zytotoxizität erfolgte durch die Berechnung des prozentualen bedeckten Bereichs mit der StainFree-Analyse. Die graphische Darstellung der IC50-Kurven erfolgte mit der SoftMax Pro Software.
Abbildung 4. Abbildungen von HeLa-Zellen, die mit toxischen Verbindungen behandelt wurden

Obere Reihe: HeLa-Zellen wurden mit wenig (links) oder viel (rechts) Anisomycin behandelt und im Durchlichtkanal aufgenommen. Untere Reihe: HeLa-Zellen wurden mit einer geringen (links) oder hohen (rechts) Konzentration an Staurosporin behandelt und dann mit dem EarlyTox Cell Integrity Kit auf Zytotoxizität untersucht. Lebende Zellen sind rot markiert und tote Zellen sind sowohl rot als auch grün markiert.
Tipp 1:
Um HeLa-Zellen ohne Färbung auszuzählen, wenden Sie entweder die „CellsA“-Einstellungen in der SoftMax Pro Software an oder definieren Sie neue Einstellungen mit dem Zeichenwerkzeug der Software. Welche Analysemethode Sie anwenden, wird von der Morphologie der Zellen und den Wachstumsbedingungen abhängig sein. Probieren Sie erst die vordefinierten Einstellungen aus und sehen Sie sich an, wie dies dargestellt wird.
Tipp 2:
Wachstumskurven wie die hier gezeigten zu erhalten, wird mit der „Field Analysis“-Funktion der SoftMax Pro Software vereinfacht. Die Field Analysis berechnet den prozentualen Bereich, der in der Abbildung mit Zellen bedeckt ist (Konfluenz). Die Berechnung der Zellkonfluenz kann auch bei der Entwicklung von Assays hilfreich sein. Zum Beispiel können Sie ihre Zellen bei unterschiedlichen Dichten untersuchen und bestimmen, welche die besten Assayergebnisse liefert.
Tipp 3:
Die Zytotoxizität über die Zeit zu überwachen ist einfach. Analysieren Sie einfach den prozentualen Bereich, der zu den gewünschten Zeitpunkten mit Zellen bedeckt ist, und stellen Sie die Ergebnisse in der SoftMax Pro Software graphisch dar. Es ist nicht notwendig, die Zellen zu färben oder zu ernten.
HeLa Zellanalyse-Toolkit
- SpectraMax® i3 Multi-Mode Microplate Detection Platform
- SpectraMax® MiniMax™ 300 Imaging Cytometer
- SoftMax® Pro Software
- EarlyTox™ Cell Integrity Kit
Instrumenteinstellungen
Art der Analyse: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: TL
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.