
Zellzählsystem
Beim Zellzähler: CHO-Zellen
Chinese Hamster Ovary (CHO)-Zellen sind eine Epithel-ähnliche Zelllinie, die in der biologischen und medizinischen Forschung häufige Anwendung findet. Sie wurden vor 50 Jahren entwickelt und seither in unzähligen Studien eingesetzt, angefangen bei genetischen bis hin zu zytotoxischen Studien. Sie sind für Transfektionen hoch empfänglich und sind daher zur beliebtesten Zelllinie geworden, wenn es um die Herstellung rekombinanter Proteine geht, einschließlich Therapeutika.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1. StainFree-Analyse von CHO-Zellen mit der SoftMax Pro Software
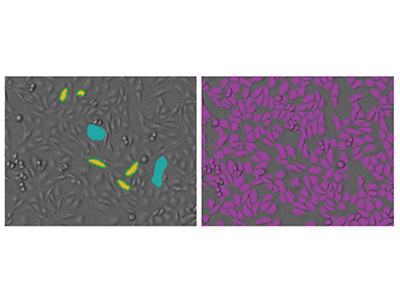
Die CHO-Zellen in diesen Bildern wurden mit 4000 Zellen pro Well in einer 384-Well-Mikroplatte ausplattiert. Links: Um eine neue Einstellung für die StainFree-Analyse zu definieren, wird mit der Maus auf der Abbildung „gezeichnet“ und einzelne Zellen (gelb) oder Bereiche, die nicht zu Zellen gehören (blau), gekennzeichnet. Rechts: Die violette Maske zeigt die Objekte, die in der Abbildung durch die Software identifiziert wurden. Alternativ kann eine vordefinierte Bildanalyse-Einstellung für eine Ein-Klick-Analyse der CHO-Zellzahl angewendet werden.
Abbildung 2. StainFree-Technologie im Vergleich zur Zellzahlbestimmung mittels Fluoreszenz
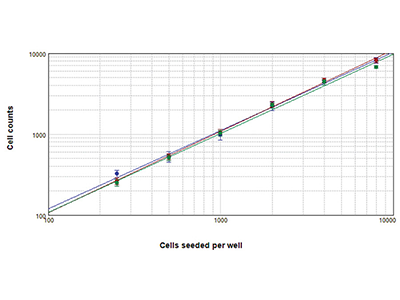
Zellen, die mit der StainFree™ Zellbestimmungs-Technologie (blau), roter Zellkernfärbung (rot) und grüner Gesamtzellfärbung (grün) ausgezählt wurden. Die Zellzahlen aus allen drei Methoden stimmen ziemlich genau überein. Dies beweist, dass die StainFree-Technologie genaue Zellzahlbestimmung liefert und gleichzeitig die Notwendigkeit für Fluoreszenzfarbstoffe beseitigt (r > 0,99 für jeden Graph).
Abbildung 3. Zellkonfluenz
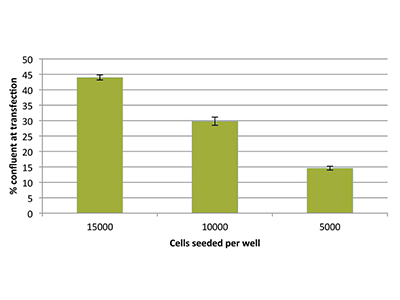
Die prozentuale Konfluenz der Zellen direkt vor der Transfektion wurde mit der StainFree-Technologie bestimmt. Für die anfängliche Dichte von 15000, 10000 und 5000 Zellen pro Well stieg die gemessene prozentuale Konfluenz bei einem Wachstum über Nacht auf 44, 30 bzw. 15 an.
Abbildung 4. Abbildung von GFP-transfizierten Zellen
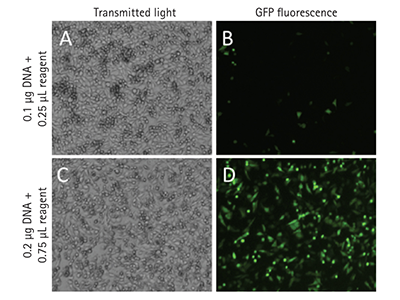
Die transfizierten Zellen wurden mit dem Durchlicht (A, C) und den grünen Fluoreszenzkanälen (B, D) des SpectraMax MiniMax 300 Imaging Cytometer aufgenommen. Die gezeigten Zellen wurden mit 15000 Zellen pro Well in einer 96-Well-Platte ausgesät. Gezeigt sind zwei Transfektionsbedingungen, die eine geringe (B) und eine hohe (D) Transfektionseffizient repräsentieren. Die StainFree-Technologie wurde angewendet, um einzelne Zellen zu identifizieren, die dann als positiv oder negativ für die GFP-Expression klassifiziert werden konnten.
Tipp 1:
Um CHO-Zellen ohne Färbung auszuzählen verwende ich die in der SoftMax Pro Software vordefinierte Einstellung „CellsA“. Diese funktioniert sehr gut für CHO-Zellen, die zwischen 5 % und 95 % konfluent sind. Wir konnten aus ein und derselben Probe ausgezeichnete Korrelationen zwischen der Zellzahlbestimmung mit Stain-Free und den fluoreszent gefärbten Zellkernen erzielen. (Siehe Abb. 2 und 3).
Tipp 2:
Wie man noch genauere StainFree-Zellzählungen erzielt. Wenn Sie Abbildungen im Durchlicht-Kanal aufnehmen, versuchen Sie, anstatt einer Fokus-Anpassungshöhe die Ihnen das schärfst-mögliche Bild liefert, die Fokus-Anpassungshöhe auf eine etwas negativere Position zu senken, z. B. von 0 auf -20. Sie wollen, dass die Zellen in Ihrem Bild helle Zentren und dunkle Ränder haben. Dies wird Ihnen eine Menge Zeit ersparen und Ihnen mit den vordefinierten Analyseeinstellungen bessere Ergebnisse liefern.
CHO Zellanalyse-Toolkit
- SpectraMax® i3 Multi-Mode Microplate Detection Platform
- SpectraMax® MiniMax™ 300 Imaging Cytometer
- SoftMax® Pro Software
Instrumenteinstellungen
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.