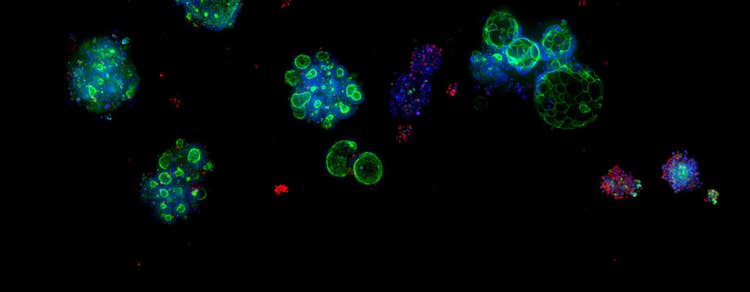
Eine Fallstudie zu Assay-bereiten, von Patienten stammenden Organoiden (PDOs) und High-Throughput-3D-Imaging für Fortschritte in der Wirkstoffforschung
Einführung – das Problem.
Einer Studie der London School of Economics im März zufolge liegen die durchschnittlichen Kosten für die Mitnahme eines neuen Medikaments in die Klinik bei etwa 1 Milliarde Dollar 2020 ( www.lse.ac.uk). Dies ist zum Teil auf die schlecht repräsentativen Modelle zurückzuführen, die zum Screening in den frühen Stadien der Wirkstoffforschung verwendet werden, was zu einer hohen Versagensrate von Verbindungen später in der Wirkstoffentwicklungs-Pipeline führt. Dies hat die Suche nach patientenzentrierteren Modellen für eine frühzeitige, präzise Auswahl von Leitkandidaten für die weitere klinische Entwicklung vorangetrieben.
Aus Patienten gewonnene Organoide (PDOs oder nur „Organoide“), die in drei Dimensionen gezüchtet werden, stellen eine Lösung für dieses Problem dar. Sie sind Miniaturkopien des normalen oder erkrankten menschlichen Biopsiegewebes, aus dem sie stammen, und repräsentieren vollständig 3D-Gewebe im menschlichen Körper. Die Evidenz zeigt, dass Patienten und ihre abgeleiteten Organoide, die mit denselben Wirkstoffen behandelt werden, eine gespiegelte Reaktion zeigen (Vlachogiannis et al., 2018). Dies belegt den Prinzipnachweis, dass Organoide für das Screening von „Bibliotheken“ potenzieller Therapeutika verwendet werden können. Verbindungen, die die gewünschte Wirkung auf die Organoide der Patienten haben, sind wahrscheinlich bei der Behandlung der Patienten selbst wirksam.
Was sind von Patienten gewonnene Organoide (PDOs)?
- Aus normalem oder erkranktem Patienten-Biopsiegewebe gewonnen
- In 3D in einem Proteingel mit flüssigem Feed gezüchtet
- Aus mehreren Zelltypen gebildet (wie Organe im Körper)
- Miniatur-Organreplikate (z. B. „Mini-Darm“)
- Vollständig repräsentativ für die Humanbiologie
- Patent „Avatare“ für die Verwendung in der Wirkstoffforschung
- In einem Bioprozessor gezüchtet, um Millionen standardisierter Kopien pro Charge zu erzeugen
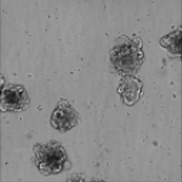
Hellfeldbild von 3D, kolorektalem Karzinom, von Patienten stammenden Organoiden (PDOs)
Im Idealfall würden, sobald die Wirkstoffe ordnungsgemäß getestet und für die Verwendung in der Klinik zugelassen wurden, individuelle Behandlungen für jeden Patienten auf der Grundlage des Ansprechens seiner eigenen Organoide entwickelt. Leider dauert es im Labor derzeit mehrere Wochen, Organoide abzuleiten und zu erweitern. Ärzte würden nicht so lange warten wollen, bevor sie die Therapie beginnen. Eine personalisierte Therapie kann in Zukunft möglich sein, da die Technologie zur Ableitung, Kultivierung und Erweiterung von Organoiden weiter verfeinert und entwickelt wird.
3D-Organoide sind eine relativ neue Technologie und Assays, um sie voll auszuschöpfen, werden noch erfunden und entwickelt. Forscher sind mehr an die Arbeit mit 2D-Zell-Monolayern gewöhnt, die viel weniger komplex sind, aber die menschliche Biologie nicht genau darstellen.
Die Herausforderung – die genaue Auswahl von Verbindungen aus frühen Screenings für die weitere Entwicklung und klinische Tests.
Der Viabilitätstest ist eine gängige Methode zur Quantifizierung der Wirksamkeit von Verbindungen („Wirksamkeit“). Eine häufig verwendete Technik ist ein biolumineszenter Assay, der das Vorhandensein von metabolisch aktiven Zellen durch Messung der ATP-Konzentrationen nachweist. High-Content-Imaging kann auch zur Bestimmung der Überlebensfähigkeit von Zellen verwendet werden, indem die Anzahl lebender oder toter Zellen (markiert mit Farbstoffen wie Calcein AM, einem gebräuchlichen Lebendzellmarker) in einer mit Wirkstoffen behandelten Probe im Vergleich zu einer unbehandelten Kontrolle (und möglicherweise Organoiden, die aus Nicht-Krebsgewebe gewonnen werden) gezählt wird. Die erwünschte Wirkung von Wirkstoffen, die in der Therapie verwendet werden, besteht darin, so viele Krebszellen wie möglich abzutöten, ohne das gesunde Gewebe zu beeinträchtigen. Die Anzahl der noch lebenden Zellen in der unbehandelten Probe wird erheblich höher sein als in den mit Wirkstoffen behandelten Zellen, insbesondere wenn hohe Konzentrationen der Therapie verwendet werden. Daher ist es wichtig, den Unterschied zwischen den beiden Bedingungen zu quantifizieren und festzustellen, ob Antikrebsverbindungen wie Trametinib wirksam sind. Dasselbe Prinzip kann verwendet werden, um neue Therapeutika zu identifizieren, die effektiv arbeiten, um Krebszellen im Rahmen eines Screenings aus einer Bibliothek von Verbindungen abzutöten.
Nicht alle Arzneimittel wirken auf die gleiche Weise. Einige Arzneimittel wirken spezifisch auf eine gezielte Untergruppe von Zellen oder verändern Signale innerhalb der Zellen, um ein erneutes Wachstum und die Ausbreitung der Krankheit zu verhindern. Es gibt keine Massenzellabtötungseffekte, so dass die Unterschiede zwischen gesunden Zellen und Krebszellen nicht einfach durch die Zählung der Anzahl der nach der Behandlung verbleibenden Lebendzellen unterschieden oder quantifiziert werden können. Alternative Methoden sind erforderlich.
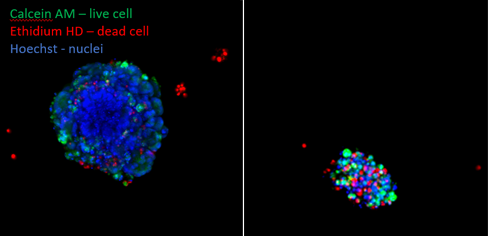
Organoide von kolorektalen Karzinomen wurden unbehandelt gelassen (A) oder Trametinib (5 mM) ausgesetzt (B). Sie wurden nach 5 Tagen gefärbt, um die Lebendzellen (grün, Calcein AM) und toten Zellen (rot, Ethidiumhomodimer) zu zeigen. Es ist klar ersichtlich, dass nach der Behandlung mit Trametinib nur noch sehr wenige Lebendzellen übrig sind.
Die Lösung – zur Detektion der subtilen Auswirkungen von Wirkstoffen, die auf bestimmte Ziele wirken, durch High-Throughput-3D-Imaging
Wissenschaftler haben beobachtet, dass die Behandlung von Organoiden mit Wirkstoffen zu einer deutlichen Veränderung des Aussehens (Morphologie) führen kann, die mit der Wirkung des Wirkstoffs auf die Zellen zusammenhängt. Zusätzlich zur Überlebensfähigkeit können der Probe weitere Fluoreszenzmarker hinzugefügt werden, um zell- und organellespezifische Informationen zu erhalten – wie die Zytoskelettstruktur, Mitochondrien und die allgemeine Organoidmorphologie. Das Erfassen von Bildern von Organoiden mit High-Content-Imaging und die Verwendung von Datenanalysewerkzeugen zur Quantifizierung von Veränderungen kann daher potenziell verwendet werden, um anzuzeigen, wann eine unbekannte Verbindung eine Wirkung zeigt. Dies ist insbesondere dann relevant, wenn ein Lebend-/Totzell-Assay keinen Unterschied zwischen behandelten und unbehandelten Zellen nachweisen kann. (Badder et al., 2020).
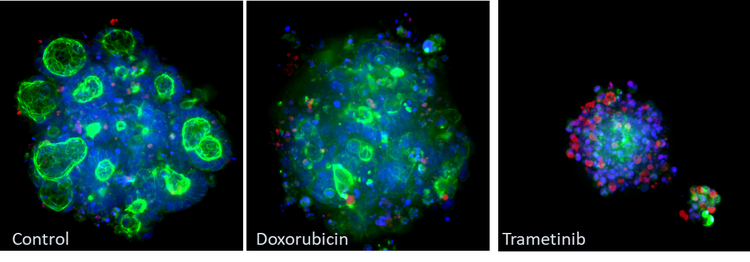
Beispiel für mit dem Molecular Devices ImageXpress® Micro Confocal System erfasste morphologische Veränderungen. CRC-Organoide wurden mit Phalloidin (grün), Hoechst (blau) und Ethidium Homodimer (rot) fixiert. Beachten Sie die Veränderungen in der Phalloidin-Färbung (grün) zwischen der Kontroll- und der Behandlungsgruppe
Um das Prinzip, dass das 3D-Organoid-Imaging in der Wirkstoffforschung eingesetzt werden kann, weiter zu demonstrieren, nutzte Cellesce die hochmoderne Automatisierung von Molecular Devices, die Imaging-Technologie und die fortschrittliche Analyse der 3D-Imaging-Datensätze, um die physikalischen Eigenschaften unbehandelter und mit Wirkstoffen behandelter kolorektaler Krebsorganoide zu vergleichen. Zur Analyse der CRC-Bilder wurden auf künstlicher Intelligenz basierende Bildanalysewerkzeuge verwendet, und zur Quantifizierung der Auswirkungen der Behandlung wurden verschiedene phänotypische Deskriptoren verwendet. Ein Beispiel für eine der Messungen, die durchgeführt werden können, d. h. die Gesamtfläche, ist unten dargestellt.
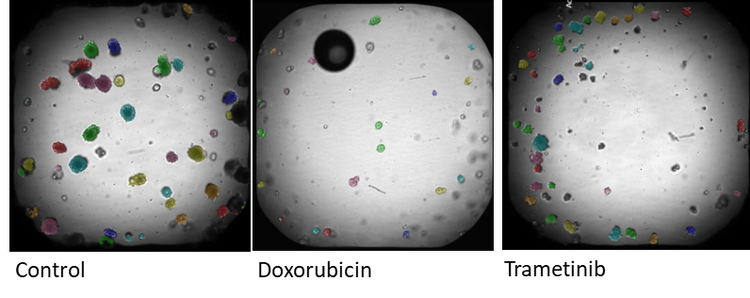
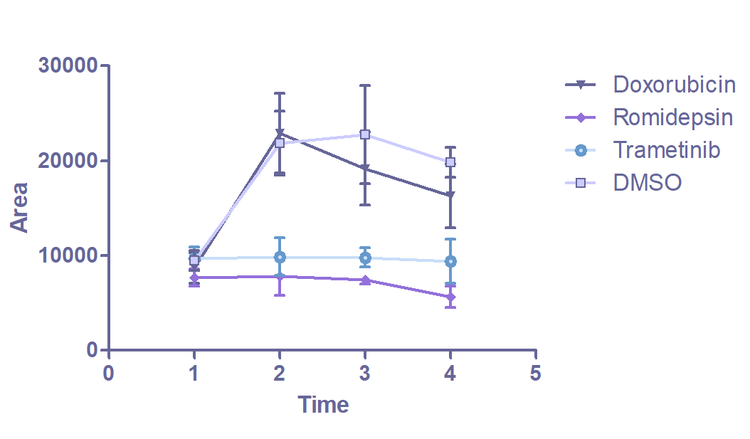
Bilder von Organoiden, aufgenommen auf dem ImageXpress Confocal. Hellfeld-Imaging wird verwendet, um Veränderungen der Organoidmorphologie im Laufe der Zeit zu überwachen. Die Analyse wird in der IN Carta Bildanalysesoftware durchgeführt. Jedes identifizierte Organoid ist mit einer farbigen Maske überlagert. Das Diagramm (E) zeigt die Veränderung der durchschnittlichen Organoidfläche über 5 Tage.
Die größte Verringerung der Gesamtfläche wird bei Organoiden beobachtet, die mit den Wirkstoffen Romidepsin und Trametinib behandelt wurden. Im Vergleich zur Kontrolle konnte durch die Behandlung mit Romidepsin und Trametinib das Wachstum der Organoide gestoppt werden. Dieses Ergebnis steht im Einklang mit den Daten des Überlebensfähigkeits-Assays, bei dem mit Romidepsin und Trametinib behandelte Organoide im Vergleich zur unbehandelten Kontrolle einen signifikanten Anstieg toter Zellen (als Anteil der Gesamtzahl der Zellen) aufweisen. Die erste Analyse der Imaging-Daten bestätigte den Zusammenhang zwischen der Organoid-Morphologie und dem Ansprechen auf das Arzneimittel. Dies belegte den Prinzipnachweis, dass diese Technik in Wirkstoffscreenings verwendet werden kann.
Die Verwendung von Organoiden und 3D-Imaging hat das Potenzial, das frühe Screening in der Wirkstoffforschung zu revolutionieren. Dies erfordert standardisierte und wiederholbare Chargen einer großen Anzahl von Organoiden. Da Organoide manuell kultiviert werden, kann diese Anforderung nicht leicht erfüllt werden. Cellesce hat diesen Bedarf durch die Entwicklung eines patentierten Bioprozesses bewältigt. Diese neuartige, einzigartige Technologie verwendet Bioprozessoren für die kontrollierte Produktion ausreichender Mengen an Organoiden für das High-Throughput-Screening. Molecular Devices adressiert die zusätzlichen Anforderungen an die Automatisierung der Probenhandhabung mittels Robotik und der Assayoptimierung mittels Imaging und Datenanalyse.
Die Verwendung assaybereiter Organoide zusammen mit der Automatisierung von Hochdurchsatz-Screening- und Quantifizierungs-Assays wird die genaue Auswahl von Therapeutikakandidaten aus großen Verbindungsbibliotheken erleichtern. Dies wird einen großen Beitrag zum Prozess der Identifizierung wirksamer Behandlungen und der Beschleunigung der Pipeline zur Wirkstoffforschung leisten. Die genaue Auswahl potenzieller therapeutischer Verbindungen in den frühen Phasen der Wirkstoffforschung wird den Ressourcenabfall und die Entwicklungskosten reduzieren. Dies wird zu einer Erhöhung der Anzahl der auf dem Markt erhältlichen Arzneimittel führen. Ärzte können so gezielte Behandlungen auswählen, die für jeden Patienten am besten geeignet sind, mit minimalen unerwünschten Nebenwirkungen. Dies verbessert die Lebensqualität und erhöht die Überlebensraten.
* Ende *
Verbesserung der Arzneimittelentwicklung: Molecular Devices und Cellesce zielen darauf ab, die Verwendung von Organoiden voranzutreiben
Die kürzliche Übernahme von Cellesce bestätigt das Engagement von Molecular Devices, in 3D-Biologietechnologien zu investieren, die den Wirkstoffforschungsprozess transformieren und die Entwicklung neuartiger Therapeutika vorantreiben.
„Molecular Devices verfügt über die Fähigkeit, den Ruf, die Reichweite und die Ressourcen, um sicherzustellen, dass die Cellesce-Technologie weiterentwickelt und ihr volles Potenzial ausgeschöpft werden kann“, sagte Vicky Marsh-Durban, CEO von Cellesce. „Wir freuen uns, Molecular Devices unsere Fachkenntnisse und unser geistiges Eigentum zur Verfügung zu stellen, um gemeinsam die Wirkung für unsere Kunden bei der Revolutionierung der Wirkstoffforschung zu maximieren und das volle Potenzial der humanrelevanten 3D-Biologieforschung auszuschöpfen.“
Tauchen Sie tiefer in das Gespräch mit Tanya Samazan aus Instrument Business Outlook und der Präsidentin Susan Murphy und Cellesce CEO Vicky Marsh-Durban von Molecular Devices ein.

Laden Sie unser Organoid-E-Book herunter
Wenn Sie bereit sind, Ihre Forschung um eine weitere Dimension zu erweitern, befasst sich das E-Book „Der wesentliche Leitfaden für Organoide in der Wirkstoffforschung“ mit der Geschichte, der aktuellen Rolle und den zukünftigen Auswirkungen von Organoiden in der Wirkstoffforschung und wie Sie Organoide erfolgreich in Ihre Forschung integrieren können.