
Zellzählsystem
Beim Zellzähler: HEK293-GFP-Zellen
Humane embryonale Nieren 293-Zellen, auch als HEK293 (Human Embryonic Kidney), 293-Zellen oder sogar als HEK-Zellen bekannt, bilden eine Zelllinie, die aus einer humanen embryonalen Niere stammen. Alex van der Eb isolierte diese Zellen in den frühen 1970ern in seinem Labor an der Universität von Leiden, Holland. Ein anderes Mitglied seines Labors transformierte die Zellen mit einem Adenovirus, wodurch die Zelllinie entstand, die heute verwendet wird. HEK293-Zellen sind einfach zu kultivieren und zu transfizieren. Deshalb wurden sie in Transfektions-basierten Experimenten, der Proteinexpression und der Impfstoff-Produktion großflächig eingesetzt. Wir haben HEK293-Zellen abgebildet, die mittels eines Lentivirus mit dem Grün fluoreszierenden Protein (GFP, GenTarget Inc.) transformiert wurden, um eine mit dem SpectraMax MiniMax 300 Imaging Cytometer durchgeführte Analyse der Zellkonfluenz zu präsentieren.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1: Identifizierung von HEK293-Zellen mit StainFree
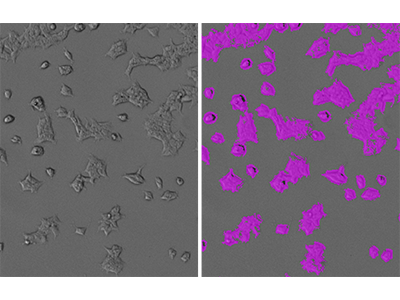
HEK293-GFP-Zellen wurden mit dem SpectraMax i3 MiniMax 300 Imaging Cytometer aufgenommen und die Zellen wurden mit einer benutzerdefinierten Einstellung des Analysebereichs identifiziert. Auf der linken Seite ist das originale Durchlichtbild gezeigt. Auf der rechten Seite ist dasselbe Bild mit einer violetten Maske dargestellt, die die von der Software identifizierten konfluenten Bereiche kennzeichnet.
Abbildung 2: Zelluläre Bereiche und Hintergrundbereiche definieren

Verwendung des Zeichenwerkzeugs in der SoftMax Pro Software zur Definition von zellulären Bereichen (gelb) und Hintergrundbereichen (blau) in den Aufnahmen.
Abbildung 3: HEK293-GFP-Zellen, aufgenommen mit dem MiniMax Cytometer
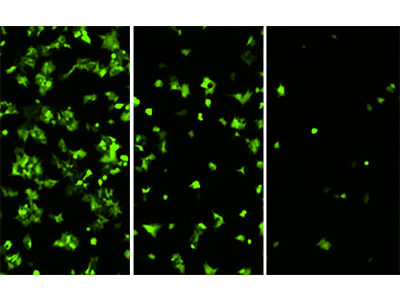
HEK293-GFP-Zellen, ausgesät bei 20000, 5000 und 1250 Zellen pro Well und mit dem grünen Fluoreszenzkanal des Minimax Cytometer aufgenommen.
Abbildung 4: StainFree- vs. Fluoreszenz-Analyse
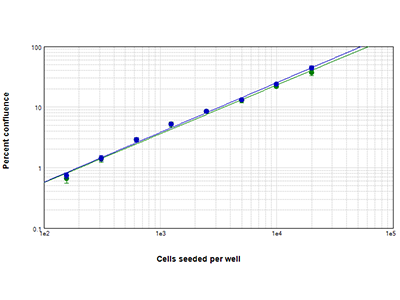
Vergleich der konfluenten Bereiche, die mit der StainFree-Analyse (blaue Kreise) und der Fluoreszenz-Analyse (grüne Kreise) bestimmt wurden. Die Prozentwerte für Konfluenz stimmen fast perfekt mit den Fluoreszenz-analysierten Konfluenzwerten überein.
Tipp 1:
Manchmal sind Zellen zu verklumpt, um sie einzeln zu zählen. In diesen Fällen können die „Field Analysis“-Einstellungen der SoftMax Pro Software angewendet werden, um von Zellen bedeckte Bereiche oder die prozentuale Konfluenz zu definieren. Die StainFree-Analyse kann für Zellen angewendet werden, die im Durchlichtkanal aufgenommen wurden. Für manche Zelltypen wird eine vordefinierte „Cells“-Einstellung in der Software die mit Zellen bedeckten Bereiche genau und automatisch identifizieren. Diese vordefinierten Einstellungen funktionieren für HEK293-Zellen ziemlich gut und können genutzt werden, um die Konfluenz für Qualitäts- und Kontrollzwecke zu abzuschätzen.
Tipp 2:
Falls etwas präzisere Schätzungen der Konfluenz erforderlich sind, stellt wahrscheinlich eine benutzerdefinierte Einstellung die richtige Herangehensweise dar. Ein Schlüsselfaktor, um genaue Messungen der Zellkonfluenz zu erhalten ist, manche Bereiche mit dem „Background“-Werkzeug einzuzeichnen, die sehr nahe an, jedoch außerhalb der Grenzen konfluenter Bereiche sind. Das ist hilfreich, um die Größe des Bereichs minimal zu halten, der an die Zellen anschließt, die als zellbedeckter Bereich definiert und gezählt werden.
HEK293-GFP Zellanalyse-Toolkit
- SpectraMax ® i3 Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Instrumenteinstellungen
Art der Analyse: Field Analysis
Wellenlänge zum Auffinden konfluenter Bereiche: TL oder 541
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.