
Zellzählsystem
Beim Zellzähler: U937-Zellen
U937-Zellen wurden im Jahr 1974 aus einem histiozytären Lymphom eines 37 Jahre alten männlichen Patienten isoliert. Da sie eine der wenigen verfügbaren Zelllinien ist, die viele monozytische Eigenschaften aufweisen, wird sie oft eingesetzt, um das Verhalten und die Differenzierung von Monozyten zu erforschen. U937-Zellen durchlaufen die Apoptose, wenn sie mit dem Granulozyten-Makrophagen-Kolonie-stimulierenden Faktor, (GM-CSF, granulocyte macrophage colony-stimulating factor; Okuma et al., 2000) behandelt werden. Dadurch sind sie ein hilfreiches Modell zur Erforschung der apoptotischen Zellsignalisierung.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1: Abbildungen, die mit dem SpectraMax MiniMax Cytometer aufgenommen wurden

U937-Zellen, identifiziert mit den vordefinierten Analyseeinstellungen „CellsC“ der SoftMax Pro Software. Links: Durchlichtaufnahme, rechts: StainFree-Analyse mit violetter Maske, die die von der Software identifizierten Zellen hervorhebt.
Abbildung 2: Zellzahlbestimmung mittels StainFree vs. Zellzahlbestimmung mittels Fluoreszenz
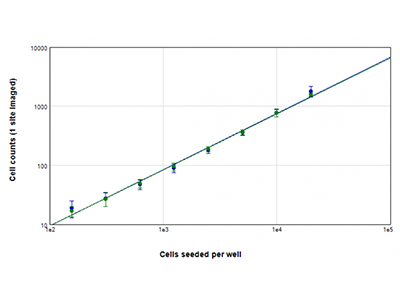
Die U937-Zellen wurden bei Zelldichten von 156 bis 20.000 Zellen pro Well ausgesät und die Zellkerne wurden mit der EarlyTox™ Live Green Dye gefärbt. Die Bilder wurden an 1 Position pro Well aufgenommen. Dann wurde die Zellzahl entweder durch die Anwendung der StainFree-Methode (blauer Graph) oder das Auszählen grün fluoreszierender Zellkerne (grüner Graph) bestimmt.
Abbildung 3: EarlyTox Live/Dead Assay
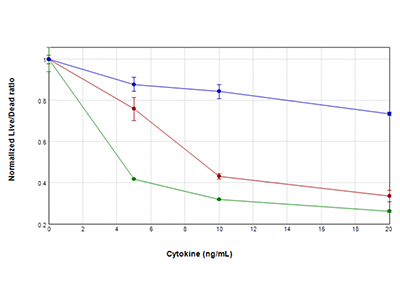
Die U937-Zellen wurden mit GM-CSF (blauer Graph), TNFα (roter Graph) oder TNFα plus GM-CSF (grüner Graph) inkubiert. Die Behandlung erfolgte für 48 Stunden in Konzentrationen von 0 ng/ml bis 20 ng/ml. Anschließend wurde die Viabilität der Zellen mit dem EarlyTox™ Live/Dead Assay-Kit untersucht. Die Fluoreszenz wurde mit dem SpectraMax i3x Multi-Mode Microplate Reader detektiert. Das Verhältnis der Fluoreszenzsignale für lebende / tote Zellen wurde verglichen mit der Zytokinkonzentration grafisch dargestellt. Es zeigte sich ein Viabilitätsverlust der Zellen, die behandelt wurden. Dieser war dann besonders schwerwiegend, wenn TNFα und GM-CSF kombiniert vorlagen.
Abbildung 4: EarlyTox Caspase-3/7 R110 Assay
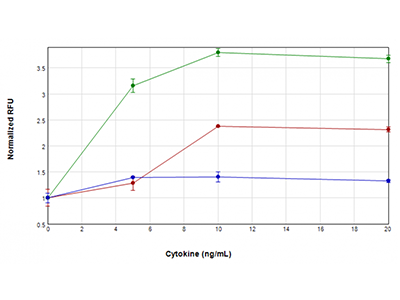
Die U937-Zellen wurden mit TNFα plus GM-CSF (grüner Graph), TNFα (roter Graph) oder nur GM-CSF (blauer Graph) inkubiert. Die Behandlung erfolgte für 48 Stunden in Konzentrationen von 0 ng/ml bis 20 ng/ml. Anschließend wurden sie mit dem EarlyTox™ Caspase-3/7 R110 Assay auf ihre Caspase-3/7-Aktivität überprüft. Das auf Caspaseaktivität hinweisende Fluoreszenzsignal wurde mit dem SpectraMax i3x Reader detektiert. Die höchste Caspaseaktivität wurde beobachtet, wenn die Zellen mit TNFα und GM-CSF gleichzeitig behandelt wurden. Dies deutet auf eine synergistische Aktivierung der Caspase hin.
Abbildung 5: EarlyTox Caspase-3/7 NucView 488 Assay
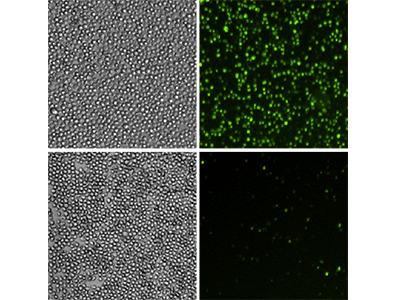
U937-Zellen wurden für 48 Stunden mit 10 ng/ml TNFα und GM-CSF behandelt (obere Reihe) oder unbehandelt gelassen (untere Reihe). Anschließend wurden sie unter Verwendung des EarlyTox™ Caspase-3/7 NucView™ 488 Assay untersucht. Eine grüne Fluoreszenzfärbung diente der Identifizierung der Zellen mit aktiver Caspase-3/7. Linkes Panel: Durchlichtaufnahmen der Zellen, rechtes Panel: grüne Fluoreszenzaufnahmen, die die Zellen mit aktiver Caspase-3/7 erkennen lassen.
Tipp:
U937-Zellen wachsen in Suspension und haben eine runde Form, die das Auszählen dieser Zellen leicht macht. Nutzen Sie für eine Zellzahlbestimmung mit StainFree einfach die vordefinierte Analyseeinstellung „CellsC“ im Dropdown-Menü der SoftMax Pro Software und analysieren Sie Zellaufnahmen mit nur einem einzigen Klick.
U937 Zellanalyse-Toolkit
- SpectraMax ® i3 Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Durchlicht (TL, transmitted light)
541 nm (grüne Fluoreszenz)
TL-Exposition: 7 ms
Anpassung TL-Fokus: -5 µm
541 Exposition: 1 ms
541 Fokusanpassung: 40 µm
Art der Analyse: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: Durchlicht (StainFree) oder 541 (grüne Zellkerne)
TL: CellsC (vordefiniert)
541: Größe und Intensität einstellen: Größe = 10 – 30 µm, Intensität über Hintergrund = 150
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3/i3x Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellerkennungs-Technologie. Diese ermöglicht es Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.