
Zellzählsystem
Beim Zellzähler: THP-1-Zellen
Vor über 40 Jahren wurde die humane Monozyten-Zelllinie THP-1 aus dem Blut eines Patienten mit Akuter Myeloischer Leukämie gewonnen und wird in der Leukämie-Forschung sowie zur Erforschung der Funktion von Monozyten und Makrophagen weit verbreitet eingesetzt. Normalerweise wachsen THP-1-Zellen in Suspension, aber sie können dazu angeregt werden, sich zu adhärenten Makrophagen-ähnlichen Zellen zu differenzieren, die IL-8 und andere Marker exprimieren. Somit können sie als Modellsystem für die Differenzierung dienen.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1: StainFree-Analyse und Bestimmung der Anzahl an Zellkernen undifferenzierter THP-1-Zellen mittels Fluoreszenz
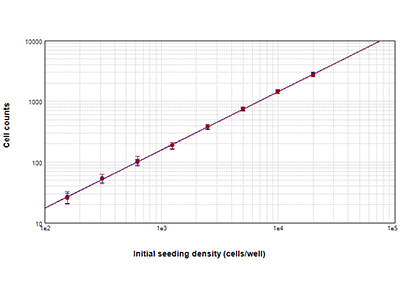
THP-1-Zellen, die bei Dichten von 156 bis 20.000 Zellen pro Well ausgesät wurden, wurden am Tag nach dem Aussäen mit der StainFree-Technologie (blaue Kreise) ausgezählt oder die Anzahl ihrer Zellkerne wurden nach der Färbung mit der EarlyTox™ Live Red Dye bestimmt (rote Kreise). Die mit beiden Methoden erhaltenen Zellzahlen wichen bei allen Zelldichten um 5 % oder weniger voneinander ab.
Abbildung 2: Undifferenzierte THP-1-Zellen, aufgenommen mit dem MiniMax Cytometer
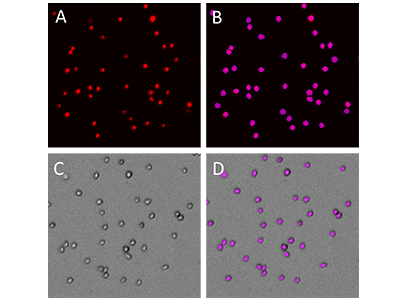
A: THP-1-Zellen gefärbt mit der EarlyTox Live Red Dye. B: Violette Objektmaske, zeigt Zellen, die von der SoftMax Pro Software bei Aufnahmen im roten Fluoreszenzkanal identifiziert wurden. C: Im Durchlichtkanal aufgenommene Zellen. D: Bei einer StainFree-Analyse im Durchlichtkanal identifizierte Zellen.
Abbildung 3: Zeitverlauf THP-1-Differenzierung
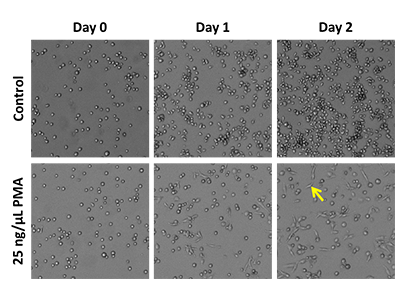
THP-1-Zellen wurden mit 20.000 Zellen pro Well in einer schwarzen 96-Well-Platte mit transparentem Boden ausgesät. Sie wurden mit 25 ng/µl PMA oder mit einer DMSO-Kontrolle behandelt. Die Zellen wurden am Tag 0, Tag 1 und Tag 2 nach der Zugabe abgebildet. Der gelbe Pfeil deutet auf eine differenzierte Zelle mit adhärenter, abgeflachter Morphologie.
Abbildung 4: THP-1-Zellproliferation
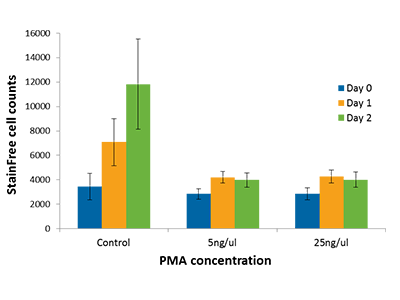
Die Zellproliferation von PMA-behandelten Zellen oder DMSO-behandelten Kontrollzellen wurde mit der StainFree-Technologie gemessen. Die Behandlung mit PMA stoppt die Zellproliferation, Kontrollzellen teilen sich jedoch weiter.
Abbildung 5: IL-8-ELISA
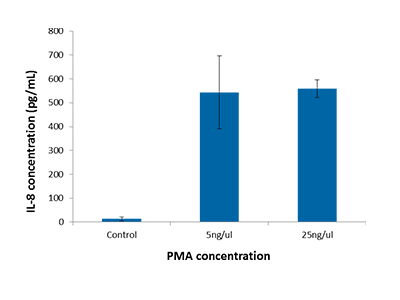
IL-8-Konzentration, gemessen mittels ELISA in PMA- oder DMSO-behandelten THP-1-Zellen. Die Zellen wurden bei 24.000 Zellen pro Well ausgesät und die Überstände wurden 48 Stunden nach dem Beginn der Behandlung für den Assay abgenommen. Der Absorptions-basierte IL-8-ELISA wurde mit dem SpectraMax i3 Microplate Reader gemessen.
Tipp:
Für Zellen in Suspension, wie undifferenzierte THP-1-Zellen, können Sie eine kürzere Expositionszeit anwenden, um die Verwischung zu vermeiden, die durch die schwebende Bewegung der Zellen verursacht wird. Das SpectraMax MiniMax 300 Imaging Cytometer ist in der Lage, Wellenlängen sehr schnell zu wechseln. Dadurch wird die Stärke der Zellbewegung, die zwischen den Aufnahmen auftreten kann, minimiert und ein besserer Overlay der in verschiedenen Kanälen aufgenommenen Bilder erzielt. Für Suspensionszellen mit runder Morphologie funktioniert die vordefinierte Durchlicht-Bildanalyse-Einstellung „CellsC“ gut. „CellsA“ identifiziert hingegen differenzierte, stärker abgeflachte Zellen genauer.
THP-1 Zellanalyse-Toolkit
- SpectraMax ® i3 Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Instrumenten-Einstellungen für Imaging und Zellzahlbestimmung
Analyseart: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: TL oder 713
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.