
Zellzählsystem
Beim Zellzähler: Aortenendothelzellen der Ratte
Aortenendothelzellen der Ratte wurden in einer Vielfalt von wissenschaftlichen Studien eingesetzt, darunter Studien zur Zell-Zell-Adhäsion, Migration, Angiogenese und der Erforschung zellulärer Signaltransduktionswege, die unter normalen und Erkrankungszuständen an der Endothelfunktion beteiligt sind. Da es primäre Zellen sind, kann ihre Verwendung in Wirkstoffscreenings kompliziert sein. Das Imaging von Lebendzellen und die Messung der Zellkonfluenz vor der Durchführung eines Assays kann für einen Erfolg entscheidend sein.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1. Durchlichtaufnahmen von Aortenendothelzellen der Ratte
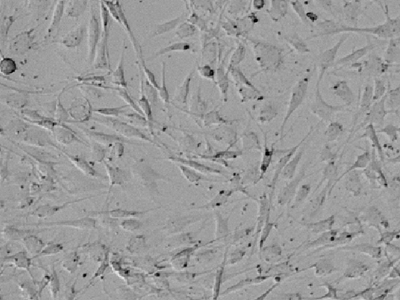
Die Aufnahme zeigt das Spektrum unterschiedlicher Morphologien und zellulärer Prozesse innerhalb einer einzelnen primären Kultur.
Abbildung 2. Zellzahlbestimmung von Aortenendothelzellen der Ratte mit StainFree

Aortenendothelzellen der Ratte wurden mit dem SpectraMax i3 MiniMax 300 Imaging Cytometer aufgenommen und die Zellen wurden mit einer benutzerdefinierten Analyseeinstellung identifiziert. Auf der linken Seite sind die original Durchlichtbilder gezeigt (oben: Kultur mit höherer Dichte, unten: Kultur mit geringerer Dichte). Auf der rechten Seite sind dieselben Bilder mit einer violetten Maske dargestellt, die die von der Software identifizierten Zellen hervorhebt.
Die Abbildungen wurden großzügigerweise von Dr. Virginia Huxley von der University of Missouri, Columbia, MO, zur Verfügung gestellt, mit Unterstützung von unserem Field Application Scientist, Randy Milano.
Tipp:
Die Imaging-Zytometrie von Aortenendothelzellen der Ratte können herausfordernd sein, da sie sehr flach sind, einige unterschiedliche Morphologien aufweisen und manchmal sogar lange Fortsätze zeigen, die an Auswüchse von Nervenzellen erinnern, wie in Abbildung 1 gezeigt. An dieser Stelle ist der Algorithmus für maschinelles Lernen der StainFree Technology sehr hilfreich. Wählen Sie in den Analyseeinstellungen die Option „Create New Settings“ und fokussieren Sie Ihre Einzeichnungen auf die Zellmitte, wobei Sie zelluläre Fortsätze (Auswüchse) ignorieren. Stellen Sie sicher, einige repräsentative Zellen mit unterschiedlichen Morphologien mit einzubeziehen, dann werden Sie Ergebnisse erzielen wie die, die in Abbildung 2 gezeigt sind.
Hilfreicher Hinweis: Die Einstellung „Focus Adjustment“ auf einen etwas negativeren Wert zu senken kann zu deutlicheren Aufnahmen dieser Zellen führen und der Software das Auszählen erleichtern.
Rat Aortic Endothelial Cells Analysis Toolkit
- SpectraMax ® i3 Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Instrumenteinstellungen
Exposition: 7 ms
Fokusanpassung: -455 µm (kann basierend auf den Eigenschaften der verwendeten Zellen optimiert werden)
Art der Analyse: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: TL
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.