
Zellzählsystem
Beim Zellzähler: HT1080-Zellen
Die Fibrosarkom-Zelllinie HT1080 wurde 1972 aus Tumorbiopsie-Gewebe generiert. Interessant ist, dass der Patient zum Zeitpunkt der Biopsie nicht mit Bestrahlungen oder einer Chemotherapie behandelt wurde, so dass die Zellen keine unerwünschten Mutationen aufweisen, die durch solche Behandlungen üblicherweise verursacht werden. Weil HT1080-Zellen hoch invasiv sind, werden häufig als Modell für die Zellinvasion und Zellmigration genutzt. Aufbauend darauf, dass es Forschern gelungen ist, das invasive Verhalten der HT1080-Zellen zu hemmen, wurden einige gegen Krebs potentiell therapeutisch wirksame Stoffe identifiziert.
Sehen Sie sich das Webinar zur StainFree-Zellerkennung an
StainFree Cell Detection Application Note herunterladen
E-Book herunterladen: Zellen zählen wie ein Profi
Abbildung 1: Imaging der Zellmigration
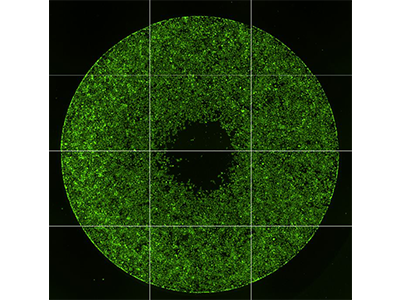
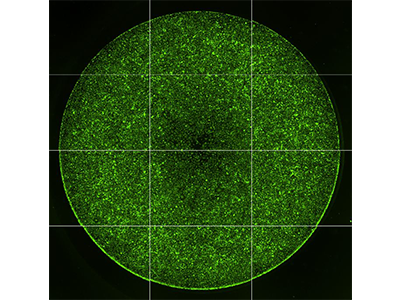
Der Oris™ Pro Cell Migration Assay von Platypus Technologies wurde eingesetzt, um die Migration von HT1080-Zellen zu messen, die mit Cytochalasin D (links) oder einer DMSO-Kontrolle (rechts) behandelt wurden. Dieser Assay nutzt ein nicht toxisches biokompatibles Gel (BCG, biocompatible gel), um auf Kulturoberflächen eine zellfreie Zone zu bilden. Nachdem Zellen in einer 96-Well-Platte ausgesät wurden, löst sich das BCG auf und ermöglicht es den Zellen, zur Mitte der Wells zu wandern (Bereich durch gelben Kreis hervorgehoben). Die Ergebnisse wurden mit dem SpectraMax MiniMax 300 Imaging Cytometer aufgenommen und die Zellen, die in die Mitte des Wells gewandert sind, wurden mit der Auswahlfunktion „Region of Interest (ROI)“ der SoftMax Pro Software ausgezählt.
Abbildung 2: Zellzahlbestimmungen mit StainFree
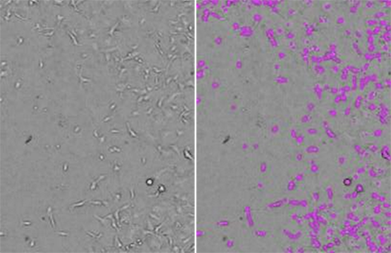
HT1080-Zellen wurden mit dem SpectraMax MiniMax 300 Imaging Cytometer aufgenommen und die Zellen wurden mit der vordefinierten Analyseeinstellung „CellsD“ identifiziert. Auf der linken Seite ist das originale Durchlichtbild gezeigt. Auf der rechten Seite ist dasselbe Bild mit violetten Masken dargestellt, die die von der Software identifizierten Zellen kennzeichnen.
Abbildung 3: Quantifizierung der Zellmigration
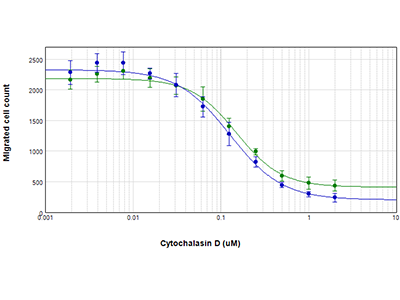
Die Zellen wurden mit Cytochalasin D behandelt und die Zellen, die anschließend in die Mitte der Wells gewandert sind, wurden mit der StainFree Technology (blaue Kreise) oder einer Fluoreszenz-Zellanalyse (grüne Zirkel) ausgezählt. Die EC50-Werte für Cytochalasin D waren 0,13 µM bzw. 0,15µM. Dies bestätigt, dass Zellen nicht gefärbt werden müssen, um die Zellmigration mit dem Oris Pro Assay genau zu bestimmen.
HT1080 Cells Analysis Toolkit
- SpectraMax ® i3 Multi-Mode Mikroplatten-Detektionsplattform
- SpectraMax ® MiniMax™ 300 Imaging Cytometer
- SoftMax ® Pro Software
Instrumenteinstellungen
Art der Analyse: Analyse getrennter Objekte
Wellenlänge zum Auffinden von Objekten: TL
Über die Technologie der StainFree-Zellerkennung
Das Imaging zellbasierter Assays benötigt üblicherweise die Verwendung von fluoreszenten Sonden, die für lebende Zellen toxisch sein können oder möglicherweise nur in fixierten Zellen funktionieren. Eine labelfreie Methode zur Analyse von Zellzahl und der Zellkonfluenz ermöglicht es Forschern, die Zellproliferation und Zellgesundheit quantitativ zu überwachen – ohne zeitaufwendige Arbeitsabläufe, die die Zellviabilität beeinträchtigen.
Die SpectraMax i3 Multi-Mode Microplate Platform mit dem MiniMax 300 Imaging Cytometer nutzt die zum Patent angemeldete StainFree-Zellbestimmungs-Technologie. Diese ermöglicht Ihnen, Zellproliferation-, Zytotoxizitäts- und andere Assays ohne Zellkernfärbungen wie DAPI, die sich in die DNA einfügen, oder Lebendzellfärbungen durchzuführen, die langfristig für Zellen toxisch sind.